น้ำไอออนไนส์
“น้ำ”..เคมีแห่งชีวิต
หากต้องการตรวจสอบว่ามีสิ่งมีชีวิตอยู่บนดาวอังคาร หรือดาวเคราะห์ดวงอื่นหรือไม่นักวิทยาศาสตร์ต้องมองหาร่องรอยของน้ำเป็นอันดับแรก ทำไมน้ำจึงสำคัญขนาดนั้น? ชีวิตทุกชีวิตบนโลกขึ้นอยู่กับน้ำ แท้จริงชีวิตมีต้นกำเนิดในน้ำ ร่างกายของสิ่งมีชีวิตประกอบด้วยน้ำ 70 ถึง 95% ทั้งนี้ขึ้นอยู่กับที่อยู่อาศัยของพวกมัน ในพืชและสัตว์ปฏิกิริยาทางเคมีทั้งหมดที่ทำให้ชีวิตอยู่รอดได้ เกิดขึ้นด้วยความช่วยเหลือของน้ำ ด้วยเหตุนี้ น้ำจึงไม่เพียงแต่เป็นตัวกลางในการเกิดปฏิกิริยาเท่านั้น แต่น้ำมักเป็นองค์ประกอบสำคัญของปฏิกิริยาเหล่านี้ด้วย
โครงสร้างของอะตอม
เพื่อที่จะเข้าใจปรากฏการณ์ของน้ำ เราต้องเข้าสู่โลกของอะตอม (atoms มาจากภาษกรีก atomos แปลว่า แบ่งแยกไม่ได้) อนุภาคที่เล็กที่สุด บางคนอาจจินตนาการว่าอะตอมเหล่านี้มีโครงสร้างเหมือนกับระบบสุริยะของเรา 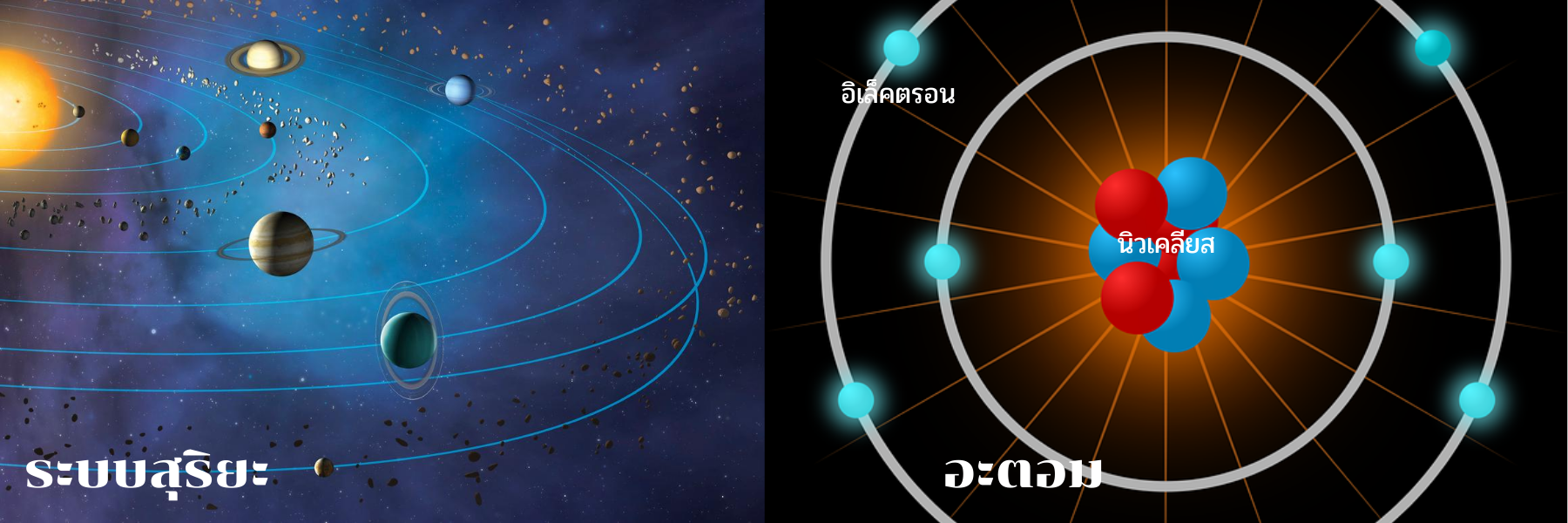 : อนุภาคที่มีประจุลบ (อิเล็กตรอน)ล้อมรอบนิวเคลียส ซึ่งประกอบด้วยโปรตอน (อนุภาคที่มีประจุบวก) และนิวตรอน (อนุภาคที่ไม่มีประจุ) อิเล็กตรอน เคลื่อนที่เป็นวงกลมในชั้นต่างๆที่เรียกว่า " shells " เช่นเดียวกับดาวเคราะห์ที่ล้อมรอบดวงอาทิตย์ อิเล็กตรอนที่เคลื่อนที่อยู่ มีระยะห่างจากนิวเคลียสแตกต่างกัน แต่แตกต่างจากดาวเคราะห์ มันเป็นไปไม่ได้ที่จะคำนวณตำแหน่งของอิเล็กตรอนบน shell ที่มันเคลื่อนที่อยู่ นักฟิสิกส์จึงใช้คำว่า "probability density" ซึ่งหมายถึง ความน่าจะเป็นที่อิเล็กตรอนจะอยู่ตรงที่มันควรจะอยู่
: อนุภาคที่มีประจุลบ (อิเล็กตรอน)ล้อมรอบนิวเคลียส ซึ่งประกอบด้วยโปรตอน (อนุภาคที่มีประจุบวก) และนิวตรอน (อนุภาคที่ไม่มีประจุ) อิเล็กตรอน เคลื่อนที่เป็นวงกลมในชั้นต่างๆที่เรียกว่า " shells " เช่นเดียวกับดาวเคราะห์ที่ล้อมรอบดวงอาทิตย์ อิเล็กตรอนที่เคลื่อนที่อยู่ มีระยะห่างจากนิวเคลียสแตกต่างกัน แต่แตกต่างจากดาวเคราะห์ มันเป็นไปไม่ได้ที่จะคำนวณตำแหน่งของอิเล็กตรอนบน shell ที่มันเคลื่อนที่อยู่ นักฟิสิกส์จึงใช้คำว่า "probability density" ซึ่งหมายถึง ความน่าจะเป็นที่อิเล็กตรอนจะอยู่ตรงที่มันควรจะอยู่
วงโคจร (shell) ชั้นแรก ประกอบด้วยสูงสุด 2 อิเล็กตรอน ชั้นที่สอง และสาม ประกอบด้วยอิเล็กตรอนสูงสุดแปดตัว แต่ละอะตอมมีความต้องการที่จะทำให้ชั้นนอกสุดสมบูรณ์โดยเติมอิเล็กตรอนให้ได้มากที่สุด เฉพาะอิเล็กตรอนของชั้นนอกสุด (valence electrons) เท่านั้น ที่มีความสำคัญต่อปฏิกิริยาทางเคมี ซึ่งเป็นตัวกำหนดลักษณะของอะตอม
นอกจากนี้อิเล็กตรอนยัง "ต้องการ" อยู่เป็นคู่เสมอ อิเล็กตรอนที่จับคู่จึงมีความสามารถในการทำปฏิกิริยาน้อยกว่าอิเล็กตรอนที่ไม่มีคู่
แม้ว่าเพื่อให้เข้าใจง่ายขึ้น วงโคจรของอิเล็กตรอนมักจะวาดเป็นวงกลมรอบนิวเคลียสของอะตอม แต่สัดส่วนที่แท้จริงนั้นจะสัมพันธ์กันอย่างคร่าวๆกับในระบบสุริยะของเรา :: ลองนึกภาพนิวเคลียสของอะตอม ซึ่งประกอบด้วยโปรตอนและนิวตรอนเป็น ลูกปิงปอง ตั้งอยู่กลางสนามกีฬาขนาดใหญ่ และน้ำหนักพอ ๆ กับสนามทั้งสนาม 
วงแหวนอิเล็กตรอนวงในสุดจะหมุนอยู่ที่ประมาณระยะของที่นั่งแถวที่ไกลที่สุด และมีขนาดประมาณหัวเข็มหมุด ซึ่งสามารถพบได้ทุกที่ และไม่สามารถพบได้ในระยะนี้ วงโคจรของอิเล็กตรอนวงถัดไปรอบลูกปิงปองที่อยู่ตรงกลางสนามกีฬา อาจอยู่ไกลถึงลานจอดรถของสนามกีฬา หรือเฮลิคอปเตอร์ที่อยู่เหนือสนามซึ่งกำลังถ่ายทอดเกมแข่งขันอยู่ "พื้นที่ควอนตัม" ระหว่างวงโคจรของอิเล็กตรอน และนิวเคลียสของอะตอมนั้น เต็มไปด้วยสนามพลังงานของปฏิสัมพันธ์ระหว่างอิเล็กตรอนและนิวเคลียสของอะตอม
จากการวิจัยในปัจจุบัน โปรตอนและนิวตรอนที่ประกอบกันเป็น "ลูกปิงปอง" ในสนามกีฬา ประกอบด้วยอนุภาคที่เล็กที่สุดซึ่งเรียกว่าควาร์ก (quarks) ซึ่งประกอบด้วย 3 "vortexes" ซึ่ง (ตามทฤษฎีของ superstring theory) มีมิติเดียว และไม่มีมวลใด ๆ vortexes เหล่านี้ – ซึ่งเป็นลักษณะของสสารด้วย – สามารถได้รับอิทธิพลจากสิ่งอื่นๆ การวิจัยของนักฟิสิกส์ชาวรัสเซีย – อเมริกัน ชื่อ Yuri Kronn และคนอื่น ๆ ชี้ให้เห็นว่าลักษณะของ vortexes พลังงาน และสสารสามารถเปลี่ยนแปลงได้โดยการสร้างสนามพลังงานทางจิต – โดยเฉพาะในน้ำ และสิ่งมีชีวิตทุกชนิดที่ประกอบด้วยน้ำ
การกล่าวถึงฟิสิกส์ควอนตัมสั้นๆ และไม่สมบูรณ์นี้ มีจุดมุ่งหมายเพื่อขยายความเข้าใจเกี่ยวกับสสารโดยทั่วไป และของน้ำ และโดยเฉพาะอย่างยิ่งความเข้าใจส่วนใหญ่ที่ได้รับอิทธิพลจากประสาทสัมผัสทางสายตาและการสัมผัส สิ่งนี้สามารถทำให้ homeopathy และปรากฏการณ์ที่มีพลังอื่น ๆ กลายเป็นสิ่งที่เป็นไปได้
จำนวนโปรตอนและนิวตรอนในนิวเคลียส เป็นตัวกำหนดลักษณะของอะตอม และกำหนดตำแหน่งของมันในตารางธาตุ - แต่ละองค์ประกอบของตารางธาตุจะถูกกำหนดโดยไม่ซ้ำกันโดยจำนวนโปรตอนและนิวตรอนในนิวเคลียส ในกรณีของอะตอมเดี่ยวที่ไม่มีประจุไฟฟ้า จะมีความสมดุลเชิงตัวเลขระหว่างโปรตอนในนิวเคลียสและอิเล็กตรอนในวงโคจร ถ้าอิเล็กตรอนถูกกำจัดออกจากวงโคจร หรือมีการเพิ่มอิเล็กตรอนใหม่ อะตอมจะถูกเรียกว่า positively or negatively "ionised" – จำนวนโปรตอนจะยังคงเท่าเดิมเสมอ และสามารถเปลี่ยนแปลงได้โดย nuclear fission เท่านั้น ซึ่งจะกลายเป็นสสารตัวอื่น
โมเลกุลของน้ำ
คนส่วนใหญ่คิดว่า น้ำ (H2O) เป็นสสารที่ไม่น่าสนใจ เป็นแค่ของเหลวใส ไร้กลิ่น ไร้รส มีอยู่ทั่วไป น้ำ เป็นสารประกอบที่ธรรมดาที่สุด ประกอบไปด้วยธาตุ 2 ชนิดที่พบได้บ่อยที่สุดในจักวาล นั่นคือ น้ำ ประกอบด้วย "ไฮโดรเจน 2 อะตอม จับกับออกซิเจน 1 อะตอม 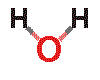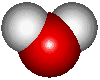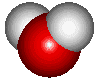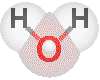 โมเลกุลของน้ำมีรูปร่าง tetrahedron นั่นคือพีระมิดที่มีฐานสามเหลี่ยมด้านเท่า มีสสารอยู่เพียงไม่กี่โมเลกุลที่เล็กกว่า หรือเบากว่าน้ำ
โมเลกุลของน้ำมีรูปร่าง tetrahedron นั่นคือพีระมิดที่มีฐานสามเหลี่ยมด้านเท่า มีสสารอยู่เพียงไม่กี่โมเลกุลที่เล็กกว่า หรือเบากว่าน้ำ
อะตอมของไฮโดรเจน (H) ประกอบด้วย โปรตอนในนิวเคลียสอะตอม และอิเล็กตรอนในเปลือกอะตอม ไฮโดรเจน ไอออนไนส์อย่างรวดเร็วโดยการสูญเสียอิเล็กตรอนตัวเดียวจึงกลายเป็น H + ที่มีประจุบวก ซึ่งเป็นโปรตอนเดี่ยวๆเนื่องจากอะตอมของไฮโดรเจนไม่มีนิวตรอน
อะตอมของออกซิเจน (O)ประกอบด้วยโปรตอน 8 ตัว บวกนิวตรอน 8 ตัวในนิวเคลียส และอิเล็กตรอน 8 ตัว ซึ่ง 2 ตัวอยู่บนเปลือกชั้นในจึงไม่ได้มีผลสำหรับปฏิกิริยาทางเคมี
ดังนั้น ออกซิเจนจึงมีเวเลนซ์อิเล็กตรอน 6 ตัว ซึ่งสองตัวจะรวมกับไฮโดรเจนสองอะตอม มันจะได้รับอิเล็กตรอนสองตัวของไฮโดรเจนมาจับคู่กัน โมเลกุลของน้ำที่เกิดขึ้นจึงมีเวเลนซ์อิเล็กตรอนทั้งหมด 8 ตัวบนเปลือกนอก - ออกซิเจนได้เติมเต็ม "ความปรารถนา" ของมันเพื่อให้มีอิเล็กตรอนแปดตัวบนเปลือกที่สอง โดยแบ่งปันอิเล็กตรอนสองตัวกับอะตอมไฮโดรเจน ในที่นี้ เรียกว่า "พันธะโควาเลนต์" (covalent bonds) แรงดึงดูดแม่เหล็กไฟฟ้าที่เกิดขึ้นจะสร้างตำแหน่งพิเศษของอิเล็กตรอน ทำให้ได้โมเลกุลที่ไม่สมมาตร ซึ่งอะตอมของไฮโดรเจนจะทำมุม 104.5 ํ กับออกซิเจน (แทนที่จะได้จากการคำนวณทางคณิตศาสตร์ 109.5 °)
ถึงแม้ว่าเราจะดื่มน้ำ, อาบน้ำ, ว่ายน้ำ และใช้น้ำทำอาหาร แต่เราก็มักจะมองข้ามความสำคัญของน้ำต่อชีวิตเรา ความแห้งแล้ง ทำให้เกิดทุพภิกขภัย แต่หากเกิดน้ำท่วม จะทำให้เกิดโรคและผู้คนล้มตายได้ ร่างกายมนุษย์ประกอบด้วยน้ำกว่า 50% หากปราศจากน้ำ เราจะตายภายใน 2-3 วัน น้ำ ทำหน้าที่เป็นทั้งตัวทำละลาย (solvent), ตัวละลาย (solute), ตัวทำปฏิกิริยา (reactant), ตัวเร่งปฏิกิริยา (catalyst), และสารชีวโมเลกุล (biomolecule), ทำหน้าที่เป็นโครงสร้างของโปรตีน, กรดนิวคลีอิก และเซลล์ และควบคุมสติของเรา H2O เป็นโมเลกุลที่พบได้เป็นอันดับสองในจักรวาล (รองจากไฮโดรเจน -H2) ร่างกายเรามีโมเลกุลของน้ำมากกว่าโมเลกุลอื่นๆรวมกันหลายร้อยเท่า ในดีเอ็นเอ 1 โมเลกุล จะมีน้ำหลายพันล้านโมเลกุล ชีวิต จะไม่สามารถมีวิวัฒนาการได้หากปราศจากน้ำ ดังนั้น จึงเป็นสิ่งที่นักวิทยาศาสตร์มีความตื่นเต้นมากเมื่อมีการพบน้ำบนดาวอังคาร และดาวดวงอื่นๆ รวมทั้งดวงจันทร์ และไม่น่าแปลกใจเลย ที่น้ำมีบทบาทสำคัญในศาสนาหลายๆศาสนาของโลก
น้ำ เป็นสารที่ถูกค้นคว้าวิจัยมากที่สุดในโลก แต่ปรากฎว่า ความเข้าใจในหลักการทางวิทยาศาสตร์ที่อยู่เบื้องหลังคุณสมบัติ และพฤติกรรมของน้ำ มีอยู่น้อยมาก หรือไม่มีใครใส่ใจ ไม่เฉพาะคนทั่วไปเท่านั้น แต่รวมถึงนักวิทยาศาสตร์ที่ทำงานเกี่ยวกับน้ำอยู่ทุกวี่ทุกวันด้วย น้ำ สามารถมีคุณสมบัติ ลื่น และเหนียว ในเวลาเดียวกัน และด้วยคุณสมบัติ 'stick/slip' นี่เอง ที่ทำให้เราจดจำได้เมื่อเราสัมผัสน้ำ โมเลกุลที่มีขนาดเล็กของน้ำ กลับตรงข้ามกับการทำงานที่ซับซ้อน และความสามารถอันเฉพาะตัวของมัน ความพยายามมากมายที่จะสร้างโมเดลของน้ำในลักษณะสารที่มีโครงสร้างเรียบง่าย ต่างก็ประสบความล้มเหลว คุณสมบัติที่เฉพาะตัวของน้ำ และความสามารถที่จะปรับเปลี่ยนไปตามสิ่งแวดล้อม ดูเหมือนจะเป็นสิ่งที่ชีวิตต้องการ โดยที่ไม่มีโมเลกุลอื่นใดสามารถทำได้
ขั้ว (polarity) ของโมเลกุลของน้ำมีความสำคัญมาก!
เนื่องจากอะตอมทั้งสามในโมเลกุลของน้ำมีขนาดแตกต่างกัน อะตอมของออกซิเจนมีขนาดใหญ่กว่าอะตอมของไฮโดรเจนทั้งสองมาก อิเล็กตรอนจึงถูกดึงดูดไปยังองศาที่ต่างกันโดยนิวเคลียสของอะตอม แรงดึงดูดของอะตอมต่ออิเล็กตรอนเรียกว่า "อิเล็กโทรเนกาติวิตี - electronegativity" ด้วยค่า 3.5 ค่าอิเล็กโตรเนกาติวิตีของออกซิเจนจะมากกว่าไฮโดรเจน (ซึ่งมีค่า 2.1) เกือบสองเท่า สิ่งนี้มีผลกระทบอย่างมากต่ออิเล็กตรอนของไฮโดรเจนทั้งสองอะตอม: อิเล็กตรอนทั้ง 2 ตัวซึ่ง "ผูก" เข้ากับโมเลกุลของน้ำ จะถูกดึงเข้าใกล้ออกซิเจนมากขึ้นส่งผลให้มีประจุเป็นลบเล็กน้อย (δ-) ที่ปลายอีกด้านของโมเลกุล ในขณะที่ไฮโดรเจนทั้งสองอะตอมมีอิเล็กตรอนน้อยจึงมีประจุบวกเล็กน้อย (δ+)
โมเลกุลที่เหมือนแม่เหล็ก (มีปลายทั้ง 2 ด้านที่มีประจุตรงข้ามกัน) เรียกว่า "ไดโพล" (dipoles) เนื่องจากความแตกต่างของอิเล็กโตรเนกาติวิตีของโมเลกุลของน้ำมีสูงมาก น้ำจึงเป็นไดโพลที่แข็งแกร่ง ด้วยขั้วนี้เอง ทำให้น้ำเป็นตัวทำละลายที่ยอดเยี่ยม เนื่องจากมีขั้วที่แข็งแกร่ง จึงสามารถละลายสารที่มีขั้วได้ทั้งหมด และสร้างพันธะไฮโดรเจน ซึ่งส่วนใหญ่รับผิดชอบต่อรูปทรงเรขาคณิตพิเศษ และทำให้เกิดปฏิกิริยาของโปรตีนและกรดนิวคลีอิก
ประจุบวกและลบนี้ ทำให้น้ำตอบสนองต่ออิทธิพลของแม่เหล็กภายนอกเช่นกัน ซึ่งเป็นคุณสมบัติที่ทำให้สามารถบำบัดน้ำที่อุดมด้วยหินปูนได้ด้วยแม่เหล็ก
พันธะไฮโดรเจนช่วยให้เรามีชีวิตอยู่ได้
โมเลกุลของน้ำสร้างพันธะระหว่างโมเลกุลกับโมเลกุลของน้ำที่อยู่ติดกัน โดยแรงดึงดูดระหว่างปลายด้านลบของโมเลกุลและปลายด้านบวกของโมเลกุลที่อยู่ติดกัน สิ่งนี้เปรียบได้กับแรงดึงดูดของแม่เหล็กหนึ่งกับแม่เหล็กอีกอันหนึ่ง ดังนั้น รูปแบบของโมเลกุลของน้ำแบบ tetra-hedrons "ซ้อนกัน" จึงเกิดขึ้น
พันธะที่เรียกว่า "พันธะไฮโดรเจน" มีความแข็งแรงเพียงเศษส่วนของแรงยึดเหนี่ยวภายในโมเลกุล ดังนั้น จึงสามารถเกิดได้ง่ายมาก และยังแยกออกจากกันได้ง่ายอีกด้วย สารประกอบที่จับกันหลวมๆนี้ มีบทบาทสำคัญในการทำให้โมเลกุลอินทรีย์ขนาดใหญ่จำนวนมากเสถียร เนื่องจากจับกันหลวมๆ พวกมันจึงสามารถถูกทำลายลงอย่างรวดเร็ว และสร้างขึ้นใหม่โดยปฏิกิริยาทางชีววิทยา และทางสรีรวิทยา การแตกตัว และการจับกันใหม่นี้ ทำให้เคมีของชีวิตเกิดขึ้น
พันธะไฮโดรเจนยังก่อให้เกิดแรงตึงผิวของน้ำ (การก่อตัวของหยดน้ำ - "ผิวของน้ำ") และจุดเดือดที่ค่อนข้างสูงที่ 100°C/212°F ตามกฎของเคมี และฟิสิกส์ น้ำควรเป็นก๊าซที่อุณหภูมิห้อง, มีจุดหลอมเหลว -120°C/-148°F และจุดเดือด -75°C/-103°F พันธะไฮโดรเจนยังทำให้น้ำมีความหนาแน่นสูงสุดที่ 4°C/39°F: ที่อุณหภูมิต่ำกว่าอุณหภูมินี้ ผลึกน้ำแข็งก่อตัวขึ้นซึ่งล้อมรอบช่องว่างกลวง และต้องการปริมาตรมากขึ้น จึงเป็นสาเหตุที่ทำให้น้ำแข็งลอยอยู่บนน้ำ ที่อุณหภูมิเหนืออุณหภูมินี้ โมเลกุลของน้ำจะถูกกระตุ้นให้สั่น และต้องการปริมาตรมากขึ้นด้วย พันธะไฮโดรเจนทำให้เกิดสิ่งที่เรียกว่า "คุณสมบัติที่ผิดปกติ" ของน้ำ 63 ชนิดซึ่งทำให้สิ่งมีชีวิตบนโลกเป็นไปได้
Water Cluster (กลุ่มโมเลกุลของน้ำ)
โมเลกุลของน้ำหลายโมเลกุลรวมกันเป็น "กลุ่มโมเลกุล" โดยยึดติดกันด้วยพันธะไฮโดรเจน โครงสร้างของกลุ่มโมเลกุลของน้ำนี้ ยังคงมีการวิจัยเรื่องคุณสมบัติอยู่ แบบจำลองสำหรับการทำความเข้าใจกลุ่มน้ำกล่าวว่า โมเลกุลของน้ำแลกเปลี่ยนพันธะกัน ส่วนใหญ่ภายในกลุ่มน้ำนี้ และด้วยเหตุนี้โมเลกุลจำนวนหนึ่งจึงรวมตัวกันเป็นกระจุกขนาดใหญ่ มากหรือน้อยแล้วแต่ โดยปรากฏภายนอกเหมือนเป็นหน่วยเดียว และทำปฏิกิริยากับโมเลกุลอื่นบนพื้นผิวของมันเท่านั้น
อีกแบบจำลองหนึ่งกล่าวว่า คลัสเตอร์น้ำในอุดมคติมีรูปทรงเรขาคณิต เช่น ไอโคซาฮีดรอน (icosahedron) ซึ่งเป็นรูปทรงหลายเหลี่ยม 20 หน้า ประกอบด้วย tetrahedrons เช่นเดียวกันกับ tetrahedrons ไอโคซาเฮดรอนเป็นหนึ่งในห้าสิ่งที่เรียกว่า "Platonic solid"  tetrahedrons ยี่สิบกว่ารูปเกือบจะสามารถสร้างไอโคซาเฮดรอนได้ 1 อัน แต่มีส่วนที่เหลือเป็นช่องว่าง เช่นเดียวกับที่โมเลกุลของน้ำไม่ได้ก่อตัวเป็น tetrahedrons ที่แน่นอน ตามแบบจำลองนี้ คลัสเตอร์น้ำไม่ใช่ไอโคซาฮีดรอนที่แน่นอน แต่เป็นโครงสร้างเชิงพื้นที่ที่ประกอบด้วยพื้นที่คล้าย tetrahedrons ซึ่งการก่อตัวคล้ายกับ icosahedron
tetrahedrons ยี่สิบกว่ารูปเกือบจะสามารถสร้างไอโคซาเฮดรอนได้ 1 อัน แต่มีส่วนที่เหลือเป็นช่องว่าง เช่นเดียวกับที่โมเลกุลของน้ำไม่ได้ก่อตัวเป็น tetrahedrons ที่แน่นอน ตามแบบจำลองนี้ คลัสเตอร์น้ำไม่ใช่ไอโคซาฮีดรอนที่แน่นอน แต่เป็นโครงสร้างเชิงพื้นที่ที่ประกอบด้วยพื้นที่คล้าย tetrahedrons ซึ่งการก่อตัวคล้ายกับ icosahedron
The Platonic solids มีบทบาทสำคัญในวิทยาศาสตร์และปรัชญากรีก ในสถาบันของเพลโต พวกมันได้รับการพิจารณาว่าเป็นตัวแทนของทั้งห้าธาตุ: 
- ธาตุไฟ (Fire) : tetrahedron (เตตระฮีดรอน) - จัตุรมุขเป็นรูปทรงหลายเหลี่ยมซึ่งมีสี่หน้า
- ธาตุน้ำ (Water) : icosahedron (ไอโคสะฮีดรอน ) - ทรงยี่สิบหน้า
- ธาตุลม (Air) : octahedron (ออกตาฮีดรอน) - รูปแปดด้าน
- ธาตุดิน (Earth) : cube (คิวบ์) - ทรงลูกบาศก์
- ธาตุอีเทอร์ (Ether) : Dodecahedron - ทรงสิบสองหน้า
ดังนั้น ในวิทยาศาสตร์กรีก จึงได้กำหนดให้น้ำมีโครงสร้างแบบไอโคซาเฮดรอน - ซึ่งบางทีอาจได้รับอิทธิพลจากการสังเกตน้ำแข็ง หรือผลึกหิมะ ซึ่งโครงสร้างไอโคซาฮิดรอนสามารถมองเห็นได้ แม้ว่าจะถูกยึดเข้าด้วยกันด้วยพันธะไฮโดรเจนที่ไม่แข็งแรง แต่กลุ่มน้ำเหล่านี้ก็มีความเสถียร ภายใต้สภาวะความกดดันปกติ จะสามารถพบโมเลกุลของน้ำเดี่ยวๆที่อุณหภูมิสูงกว่า 375°C/707°F หรือที่ความดันต่ำมาก เช่นในชั้นบนสุดของบรรยากาศ
โครงสร้างพิเศษของพันธะไฮโดรเจน, แรงดันไฟฟ้าระหว่างไฮโดรเจน และออกซิเจนที่มีอยู่ในไดโพลของโมเลกุลน้ำ, ความเป็นไปได้ที่อะตอมของไฮโดรเจนที่แตกตัวเป็นไอออน (โปรตอน) และอิเล็กตรอนจะ "ย้าย" จากโมเลกุลของน้ำโมเลกุลหนึ่งไปยังอีกโมเลกุลหนึ่ง และรูปทรงเรขาคณิตของน้ำ ทำให้น้ำมีพฤติกรรมแตกต่างไปจากที่ควรจะเป็นตามกฎทางเคมีและทางกายภาพ
สารประกอบที่อ่อนแอ สามารถละลายผลึกของแข็ง
โมเลกุลของน้ำเหมาะอย่างยิ่งสำหรับการละลายสารประกอบไอออนิก เนื่องจากประจุไฟฟ้าที่แตกต่างกัน จึงสามารถแทรกระหว่างไอออนที่มีประจุบวก และประจุลบของเมทริกซ์ไอออน (ตัวอย่างเช่น ในผลึกเกลือ) และล้อมรอบอนุภาคที่มีประจุ:
เกลือ - โซเดียมคลอไรด์ (NaCl) - เป็นสารประกอบที่แข็งแกร่งเมื่อแห้ง ถ้าใส่เกลือลงในน้ำ มันจะถูกละลายโดย Na + ที่มีประจุบวก เชื่อมต่อกับขั้วลบของโมเลกุล H20 และ Cl- ที่มีประจุลบ เชื่อมต่อกับขั้วบวกของโมเลกุล H2O
ดังที่เห็นได้จากตัวอย่างง่ายๆนี้ สารประกอบที่อ่อนแอของโมเลกุลของน้ำ สามารถละลายสารประกอบผลึกที่แข็งแกร่งได้ ดังนั้น น้ำจึงเป็นตัวทำละลายที่เป็นสากล และเป็นธรรมชาติที่สามารถทำละลายสารประกอบที่แข็งแกร่งและซับซ้อนได้ นี่เป็นหนึ่งในหลักการพื้นฐานของปฏิกิริยาเคมี
น้ำ ในฐานะเป็น "ตัวทำละลาย"
น้ำ พยายามละลายสารที่มันสัมผัส ความสามารถในการละลายของน้ำขึ้นอยู่กับปัจจัยสี่ประการ:
• อุณหภูมิ: อุณหภูมิของน้ำยิ่งสูงขึ้น โมเลกุลของน้ำก็จะเคลื่อนที่เร็วขึ้น และละลายสสารได้ดีขึ้น ตัวอย่างเช่น รสชาติและสีของใบชาละลายได้ดีในน้ำร้อนมากกว่าในน้ำเย็น
• ความแตกต่างของ pH: ยิ่งความแตกต่างระหว่าง pH ของน้ำ กับ pH ของตัวถูกละลายมากเท่าไหร่ ก็ยิ่งละลายในน้ำได้ดีเท่านั้น ตัวอย่างเช่น โซเดียมไบคาร์บอเนตละลายได้ดีกว่าในของเหลวที่เป็นกรด ในขณะที่นิ่วในไตทั่วไป (เป็นผลึกของกรดออกซาลิก) ละลายในของเหลวที่เป็นด่าง
• ความอิ่มตัวของน้ำด้วยสารที่ละลาย: ยิ่งมีสารละลายในน้ำมากเท่าใด สารใหม่ก็จะละลายได้น้อยลง อย่างไรก็ตาม ผลกระทบนี้จะเกี่ยวข้องก็ต่อเมื่อปริมาณของสารที่ละลายเข้าใกล้ขีดจำกัดความอิ่มตัวของสารละลาย ดังนั้น เกลือจึงละลายได้ดีจนถึงขีดจำกัดการอิ่มตัว เมื่อถึงขีดจำกัดของความอิ่มตัว จะไม่สามารถละลายเกลือได้อีก ถ้าน้ำระเหย ผลึกเกลือจะตกผลึกออกมา
• ขนาดของคลัสเตอร์น้ำ: ยิ่งกลุ่มน้ำมีขนาดเล็กเท่าใด ก็จะสามารถละลายสารได้ดีขึ้นเท่านั้นเนื่องจากน้ำจะทำปฏิกิริยาเฉพาะที่พื้นผิวของกลุ่มน้ำเท่านั้น กลุ่มน้ำขนาดเล็กจึงมีพื้นที่ผิวมากกว่า เมื่อเทียบกับปริมาตร ขนาดคลัสเตอร์อาจได้รับอิทธิพลจากมาตรการทางกายภาพต่างๆ เช่น การเปลี่ยนแปลงทางเชิงกลหรือแม่เหล็ก, การไหลอิสระ (free flow), การระเหย, กระบวนการอิเล็กโทรลิซิส และอื่น ๆ เหล่านี้เป็นวิธีการทำให้คลัสเตอร์น้ำแตกออก และลดขนาดโครงสร้างคลัสเตอร์ ในขณะที่ความดัน - เช่น ในปั๊ม - และการไหลของน้ำตรงๆ - เช่น ในท่อน้ำ - จะเชื่อมคลัสเตอร์เข้าด้วยกัน และขยายคลัสเตอร์ให้ใหญ่ขึ้น และทำให้น้ำเคลื่อนที่ได้น้อยลง
ตัวอย่างเช่น น้ำจากธารน้ำแข็ง, น้ำจากลำธาร, น้ำที่หมุนวน หรือน้ำแตกตัวเป็นไอออนจากเครื่องไอออไนเซอร์ น้ำเหล่านี้ประกอบด้วยกลุ่มน้ำขนาดเล็ก - เรียกอีกอย่างว่า "hexagonal water" ในทางตรงกันข้าม น้ำจากท่อน้ำ เช่น จากก๊อกน้ำในครัวจะมีกลุ่มน้ำขนาดใหญ่ และมีความสามารถในการทำละลายน้อยกว่า
ปัจจัยทั้ง 4 ที่ส่งผลกระทบต่อความสามารถในการทำละลายของน้ำนี้ มีผลกระทบที่รุนแรงแตกต่างกัน: ความแตกต่างของอุณหภูมิและค่า pH มีความสำคัญมากสำหรับความสามารถในการละลาย ในขณะที่ความอิ่มตัวของสารที่ละลายนั้นแทบจะไม่เกี่ยวข้องกันเลย เนื่องจากสารละลายอิ่มตัวมักไม่ค่อยใช้เป็นตัวทำละลายอยู่แล้ว ขนาดคลัสเตอร์จึงมีความเกี่ยวข้องโดยเฉพาะอย่างยิ่งสำหรับสารสกัดเย็น และเกี่ยวข้องกับภายในของสิ่งมีชีวิต
น้ำ เป็นตัวส่งผ่านข้อมูล
น้ำ สามารถตอบสนองต่ออิทธิพลภายนอกในระดับที่แตกต่างกัน :
- ไม่มีข้อโต้แย้ง เนื่องจากกำหนดโดยเครื่องมือวัดอย่างง่าย : คือ รูปแบบสถานะของน้ำ และปฏิกิริยา และพารามิเตอร์ทางกายภาพ และเคมี เช่น อุณหภูมิ, แรงตึงผิว, จุดเดือด, จุดเยือกแข็ง, ค่า pH, ประจุไฟฟ้า (ค่ารีดอกซ์) และการนำไฟฟ้า (แร่ธาตุที่ละลายอยู่) ในที่นี่ น้ำตอบสนองต่ออิทธิพลทางกายภาพ และทางเคมีจากสิ่งแวดล้อม
- ยากที่จะตรวจสอบ แต่ก็ยังวัดได้ คือ ขนาดคลัสเตอร์ของน้ำ ซึ่งพิสูจน์ได้ด้วยการวิเคราะห์ NMR (Nuclear Magnetic Resonance) ที่ทันสมัย
- เป็นที่ถกเถียงและอธิบายได้เฉพาะในระดับของฟิสิกส์ควอนตัมเท่านั้น คือ พารามิเตอร์ "ลึกลับ" หรือ "ละเอียดอ่อน" เช่น ทิศทางการหมุน (direction of rotation), ข้อมูลที่น้ำเป็นตัวส่งผ่าน (information content), การสั่นสะเทือน (vibrations) และอื่น ๆ อย่างไรก็ตาม ข้อมูลที่สามารถบันทึก, จัดเก็บ และส่งผ่าน โดยโมเลกุลของน้ำ มีอย่างน้อย 4 ระดับ ได้แก่: 1. ข้อมูลระดับแรก คือ ความถี่และจังหวะของการแตกตัวและการก่อตัวใหม่ของพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำแต่ละโมเลกุลในกลุ่มน้ำ ดูได้จาก โครงสร้างแบบสามมิติของโมเลกุลของน้ำแต่ละตัวที่เชื่อมต่อกันกับโมเลกุลใหม่และ "เต้น" ด้วยจังหวะหนึ่ง สันนิษฐานได้ว่า "รูปแบบการเต้น" นี้ สร้างความถี่แบบสามมิติ และจังหวะของมันสามารถถูกสร้างขึ้นจากภายนอก และสามารถมีอิทธิพลและจัดโครงสร้างของชีวิตโดยรอบในสภาพแวดล้อมที่มีชีวิต
2. ข้อมูลระดับที่สองอยู่ในเรื่องความสมมาตร: น้ำ เป็น chiral molecule (โมเลกุลที่ไม่เหมือนกับภาพสะท้อนเงาของมัน) ที่ไม่สมมาตร ซึ่งมีทิศทางการหมุน, ด้านหน้าและด้านหลัง, ขวาและซ้าย - เช่นเดียวกับ ควอตซ์คริสตัล มีหมุนขวาและซ้าย
ควอตซ์ (ซิลิกอน - Si02) มีโครงสร้างคล้ายกับน้ำ แต่เป็นของแข็ง และโมเลกุลของมันมีขนาดใหญ่กว่า เช่นเดียวกับน้ำ ควอตซ์โปร่งใส, มีการหักเหของแสง และทำปฏิกิริยากับกระแสไฟฟ้า
ผลึกควอตซ์มีสมมาตรแบบต่างๆ ที่สามารถวัดและอธิบายได้ ดังนี้:
สำหรับผลึกควอตซ์แล้ว คุณสมบัติเพียโซอิเล็กทริก (piezoelectric property - เป็นคุณสมบัติที่เกิดกับวัสดุ ซึ่งเมื่อได้รับแรงกลจะให้แรงดันไฟฟ้า (voltage) ออกมา) นี้ ถูกนำมาใช้ในทางเทคนิค ไม่มีคอมพิวเตอร์ใดที่จะทำงานได้โดยไม่ต้องใช้การสั่นไปมา (oscillations) ของ Si02: ผลึกควอตซ์ ตอบสนองต่อแรงกดด้วยสัญญาณไฟฟ้า และตอบสนองต่อสัญญาณไฟฟ้าด้วยการขยายหรือหดตัว
การเรียงตัวของโมเลกุลในกลุ่มน้ำ เป็นปัจจัยที่สามารถสันนิษฐานได้ว่า มีผลกระทบอย่างมากต่อโครงสร้างทางชีวภาพที่มีขนาดเล็กมาก เช่นเดียวกับในเทคโนโลยี จะต้องใช้ผลึกควอตซ์บริสุทธิ์ที่หมุนซ้ายหรือหมุนขวาเท่านั้น แต่เป็นของหายาก ดังนั้น ผลึกควอทซ์จึงถูกสังเคราะห์ขึ้นสำหรับการใช้งานทางเทคนิค
เนื่องจากโครงสร้างของซิลิกอน และแร่ธาตุ และผลึก ประกอบด้วยซิลิกอนเป็นส่วนใหญ่ และคล้ายกับโครงสร้างของน้ำ เรโซแนนซ์ (resonances) อาจเกิดขึ้นได้ระหว่างการสั่น (oscillations) ของผลึกซิลิกอน หรือควอตซ์และการสั่นของน้ำ บางทีนี่อาจเป็นสาเหตุหนึ่งที่ทำให้ซิลิคอน ซึ่งเป็นธาตุที่มีมากที่สุดเป็นอันดับ 2 ในโลก มีบทบาทสำคัญในร่างกายของเรา เกี่ยวข้องกับโครงสร้างของเนื้อเยื่อและสุขภาพโดยรวม การเปรียบเทียบกับโมเลกุล Si02 ซึ่งเป็นรากฐานของเทคโนโลยีสารสนเทศสมัยใหม่ แสดงให้เห็นอย่างชัดเจนซึ่งโครงสร้างข้อมูลอื่น ๆ ยังคงมีอยู่ในโมเลกุลของน้ำ แต่ยังไม่สามารถวัดได้เนื่องจากความไม่เพียงพอของเทคโนโลยีการวัด
3. ข้อมูลระดับที่สามอยู่ในโครงสร้างการสั่น (oscillating structures) ของโมเลกุล H20 เนื่องจากอะตอม H ไม่ได้สร้างมุม tetrahedron ที่แน่นอนกับอะตอม 0 มันอยู่ภายใต้ความตึงเครียดและ "แกว่ง (oscillate)" เสมอ จึงค่อนข้างสมเหตุสมผลที่จะสันนิษฐานว่า โครงสร้างการสั่นเหล่านี้อยู่ภายใต้รูปแบบคำสั่งบางอย่าง นั่นคือ มีข้อมูลอยู่ และรูปแบบเหล่านี้อาจได้รับอิทธิพลจากภายนอก ดังนั้น จึงเป็นไปได้ทางกายภาพที่รูปแบบการสั่นจากสารเคมีสามารถส่งผ่านไปยังการสั่นของโมเลกุลของน้ำโดยความปั่นป่วนรุนแรง (intense turbulence) (ในโฮมีโอพาธี)  หรือโดยแสง UV หรือแรงแม่เหล็กไฟฟ้าของดวงอาทิตย์ (บุปผาบำบัด - Bach flower essence) และถูกเก็บไว้อย่างถาวรโดยโมเลกุลของน้ำ หรือการสั่นตามธรรมชาติหรือสนามไฟฟ้าของสิ่งมีชีวิต หรือของสาร สามารถมีผลต่อรูปแบบการสั่นของโมเลกุลของน้ำ
หรือโดยแสง UV หรือแรงแม่เหล็กไฟฟ้าของดวงอาทิตย์ (บุปผาบำบัด - Bach flower essence) และถูกเก็บไว้อย่างถาวรโดยโมเลกุลของน้ำ หรือการสั่นตามธรรมชาติหรือสนามไฟฟ้าของสิ่งมีชีวิต หรือของสาร สามารถมีผลต่อรูปแบบการสั่นของโมเลกุลของน้ำ
4. ข้อมูลระดับที่สี่สามารถพบได้ในโครงสร้างทางกายภาพของควอนตัมของอะตอม .png) กล่าวคือ ในโครงสร้างภายในของพลังงาน energy vortexes ที่ก่อตัวเป็นควาร์ก (quarks) ของโปรตอนและนิวตรอนของนิวเคลียสของอะตอม เช่นเดียวกับ ในโครงสร้างของสนามพลังงานระหว่างนิวเคลียสของอะตอมของออกซิเจน กับไฮโดรเจนสองอะตอม และอิเล็กตรอนที่อยู่รอบ ๆ วิธีที่ energy vortexes และสนามพลังงานเหล่านี้ก่อตัวขึ้น, มีโครงสร้างอย่างไร และมีอิทธิพลอย่างไร เป็นเรื่องที่ยังไม่ได้รับการวิจัย เนื่องจากไม่มีเครื่องมือวัดที่เหมาะสม อย่างไรก็ตามการสังเกตที่เป็นกลาง แสดงให้เห็นว่า ทฤษฎีของฟิสิกส์ควอนตัมสามารถอธิบายปรากฏการณ์ในธรรมชาติที่ไม่สามารถอธิบายได้
กล่าวคือ ในโครงสร้างภายในของพลังงาน energy vortexes ที่ก่อตัวเป็นควาร์ก (quarks) ของโปรตอนและนิวตรอนของนิวเคลียสของอะตอม เช่นเดียวกับ ในโครงสร้างของสนามพลังงานระหว่างนิวเคลียสของอะตอมของออกซิเจน กับไฮโดรเจนสองอะตอม และอิเล็กตรอนที่อยู่รอบ ๆ วิธีที่ energy vortexes และสนามพลังงานเหล่านี้ก่อตัวขึ้น, มีโครงสร้างอย่างไร และมีอิทธิพลอย่างไร เป็นเรื่องที่ยังไม่ได้รับการวิจัย เนื่องจากไม่มีเครื่องมือวัดที่เหมาะสม อย่างไรก็ตามการสังเกตที่เป็นกลาง แสดงให้เห็นว่า ทฤษฎีของฟิสิกส์ควอนตัมสามารถอธิบายปรากฏการณ์ในธรรมชาติที่ไม่สามารถอธิบายได้
ตัวอย่างเช่น ดร. ฮูผิง หู (Huping Hu) นักวิทยาศาสตร์ชาวอเมริกันได้ทำการทดลองดังต่อไปนี้ เขาวางภาชนะแก้วที่มีคลอโรฟอร์มซึ่งเป็นยาชาที่มีฤทธิ์แรง ระหว่าง ภาชนะแก้วสุญญากาศที่บรรจุน้ำอยู่เต็ม และขดลวดแม่เหล็กซึ่งเขาสร้างสนามแม่เหล็กขึ้น (pulsating magnetic field) เมื่อผู้ทดสอบดื่มน้ำนี้ในการทดลองแบบ double-blind พบว่า มีผลกระทบที่วัดได้เช่นที่เกิดขึ้นเมื่อรับประทานหรือสูดดมยาชา ผลกระทบเหล่านี้จะรุนแรงกว่าเมื่อใช้น้ำประปามากกว่าน้ำกลั่น ซึ่งบ่งชี้ว่าแร่ธาตุในน้ำเป็นสิ่งจำเป็นสำหรับการส่งผ่านข้อมูล ผลเช่นเดียวกันนี้ยังเกิดขึ้นเมื่อวางขวดแก้วปิดสนิทที่มียาชา วางอยู่ระหว่างขดลวดแม่เหล็กและศีรษะของผู้เข้ารับการทดสอบ
ระดับข้อมูลทั้งสี่ที่กล่าวถึงและอธิบายในที่นี้ ยังไม่ได้รับการยอมรับในวิทยาศาสตร์แบบดั้งเดิม (conventional science) แต่ทั้งหมดนี้สามารถอธิบายได้ด้วยฟิสิกส์ควอนตัม
ไม่ช้าก็เร็ว จะมีวิธีการพิสูจน์การมีอยู่ และคุณสมบัติของระดับข้อมูลเหล่านี้ ด้วยเทคนิคการถ่ายภาพ หรือแม้กระทั่งการวัดค่าทางกายภาพ และเพื่ออธิบายการทำงานของ homeopathy (โฮมิโอพาธีย์), Bach flower remedies (บุปผาบำบัด) .png) , Reiki (เรกิ) หรือการรักษาด้วยพลังแห่งความคิดอันบริสุทธิ์ในทางวิทยาศาสตร์และกายภาพ
, Reiki (เรกิ) หรือการรักษาด้วยพลังแห่งความคิดอันบริสุทธิ์ในทางวิทยาศาสตร์และกายภาพ
ประวัติศาสตร์โลกในหยดน้ำ
หยดน้ำ 1 หยด มีโมเลกุลของน้ำประมาณ 1.8 x 1015 (1,800,000,000,000,000) โมเลกุล โมเลกุลของน้ำแต่ละโมเลกุลเหล่านี้ มีประวัติของตัวเองย้อนหลังไปถึงช่วงเวลาของการกำเนิดโลก มีข้อมูล, จังหวะ, ความถี่ และการสั่นสะเทือนเป็นเวลาหลายล้านปีจากธารน้ำแข็งและทะเลจากมนุษย์, สัตว์ และพืช จากลำธารและแม่น้ำ จากดินและจากชั้นบรรยากาศทั่วโลก โมเลกุลของน้ำเหล่านี้มารวมกัน และพบกัน ผสมผสานเป็นเอกลักษณ์ของการสั่นสะเทือนและ "เรื่องราว" ในหยดน้ำเพียงหยดเดียวนี้ซึ่งไม่เหมือนใคร และมีอยู่เพียงครั้งเดียวบนโลกและจะไม่เกิดขึ้นอีก
บางที "เรื่องราว" ในหยดน้ำนี้ อาจเป็นอีกสาเหตุหนึ่งที่ทำให้ชีวิตขาดน้ำไม่ได้? โมเลกุลของน้ำจะกลายเป็นโมเลกุล "ใหม่" และ "บริสุทธิ์" อีกครั้ง เมื่อแยกออกเป็นส่วนประกอบของไฮโดรเจนและออกซิเจนแล้ว "ประกอบขึ้นใหม่" อีกครั้ง ดังเช่นในอิเล็กโทรลิซิสซึ่งเกิดก๊าซไฮโดรเจนและก๊าซออกซิเจน
วัฏจักรของน้ำและอารยธรรม
น้ำระเหยและเพิ่มขึ้นในชั้นบรรยากาศด้านบนสุดสู่ชั้นสตราโตสเฟียร์ และชั้นโทรโปสเฟียร์ ในกรณีที่แรงโน้มถ่วงและความกดอากาศต่ำมาก หยดน้ำเล็ก ๆ จะถูกฉีกออก และแยกออกเป็นโมเลกุลของน้ำเดี่ยวๆ โมเลกุลของน้ำแต่ละโมเลกุลเหล่านี้ มีความสามารถโดยเฉพาะอย่างยิ่งในการดูดซับรังสี และความถี่ของดวงอาทิตย์ และจักรวาล พวกมันดูดซับแสงอาทิตย์และรังสีคอสมิก และด้วยเหตุนี้จึงป้องกันโลกจากพวกรังสีดังกล่าว - ไอน้ำเป็น "climate gas (ก๊าซเรือนกระจก)" ที่มีประสิทธิภาพมากกว่า C02 มาก เมื่อไอน้ำบรรจุเต็มไปด้วยความถี่ของจักรวาล พวกมันก็เริ่ม "เดินทางกลับ" มายังโลก รวมตัวกันเป็นก้อนเมฆ และตกลงมาเป็นสายฝน
ในช่วงไม่กี่ทศวรรษที่ผ่านมา มีการเพิ่มความถี่อื่น ๆ ที่มนุษย์สร้างขึ้นนอกเหนือจากความถี่จักรวาลตามธรรมชาติ ตั้งแต่เครื่องส่งสัญญาณคลื่นยาวที่สามารถถ่ายทอดความถี่จากสถานที่แห่งหนึ่งไปทั่วโลก และเครื่องส่งสัญญาณที่มีอิทธิพลต่อสภาพอากาศ เช่น โรงงาน HAARP ในอลาสก้า, ออสเตรเลีย และที่อื่น ๆ การสื่อสารผ่านดาวเทียม, เรดาร์, สถานีวิทยุ และโทรทัศน์ ไปจนถึงการสื่อสารเคลื่อนที่ด้วยคลื่นสั้น เครื่องส่งสัญญาณล้วนมีอิทธิพลต่อโมเลกุลของน้ำแตกต่างกัน ส่วนใหญ่เป็นความถี่ที่ดัดแปลงผิดธรรมชาติ
ย้อนกลับไปบนโลก น้ำควรจะซึมลงไปในดิน หรือจมลงสู่ก้นมหาสมุทรเพื่อชาร์จด้วยความถี่ของโลก โดยเฉพาะอย่างยิ่งความถี่ Schumann ที่ 7.83 Hz แต่ถึงกระนั้นก็ไม่ได้รับการยกเว้นจากความถี่รบกวนที่มนุษย์สร้างขึ้น และประจุไฟฟ้า บนชายฝั่ง ความถี่รบกวนเหล่านี้ส่วนใหญ่มาจากกริดไฟฟ้าแรงสูงทั่วโลกซึ่งต่อลงดินในน้ำใต้ดินจึงส่งกระแสรบกวนและความถี่ลงในน้ำ แต่ยังมาจากสายไฟ และสายเคเบิ้ลที่ฝังอยู่ในพื้นดิน สายไฟและสายเคเบิลผ่านมหาสมุทร และความถี่ในการสื่อสารของเรือดำน้ำ ส่งผลกระทบต่อน้ำ ในขณะที่เพลงของปลาวาฬที่ท่องไปในน้ำในระยะทางหลายร้อยกิโลเมตรนั้นหายากขึ้นเรื่อย ๆ
ผลกระทบของความถี่รบกวนที่มนุษย์สร้างขึ้นเหล่านี้ต่อคุณสมบัติของน้ำ และอาจมีผลต่อชีวิตทั้งหมดบนโลกยังไม่ได้รับการวิจัย รวมทั้งยังไม่มีการวิจัยเรื่องที่สิ่งมีชีวิตบนโลกไม่ว่าจะอยู่ไกลแค่ไหน ขึ้นอยู่กับความถี่ของจักรวาลแสงอาทิตย์และโลกที่ส่งมาจากน้ำ
การทำให้ข้อมูลของน้ำมองเห็นได้
"วิธีการถ่ายภาพ" ต่างๆ เช่น Drop Picture Method, Capillary Dynamolysis, Biocrystallisation หรือ Ice Crystal Method ทำให้สามารถมองเห็น "ข้อมูล" และโครงสร้างของน้ำเป็นข้อความเชิงคุณภาพได้
การรักษาด้วยข้อมูลที่บรรจุอยู่ในน้ำ
หมอชาวบ้านในสมัยโบราณ ใช้ข้อมูลน้ำเพื่อจุดประสงค์ในการรักษาอยู่แล้ว: ฮิลเดการ์ดฟอน บิงเก้น (1098-1179) แนะนำให้วางหินและคริสตัลลงในน้ำแล้วดื่ม Paracelsus (1494-1541) แยกความแตกต่างระหว่างการสั่นของน้ำที่มีลักษณะและคุณสมบัติที่แตกต่างกัน Jakob Lorber (1800-1864) แนะนำให้คนป่วยไปรับแสงแดด และให้ดื่มน้ำพุที่อาบรังสีจากดวงอาทิตย์ โฮมิโอพาธีย์ ที่พัฒนาโดย Samuel Hahnemann (1755-1843) เป็นผลมาจากความรู้เก่าแก่หลายศตวรรษนี้
จุดกำเนิดของวิทยาศาสตร์เกี่ยวกับน้ำ
น้ำ เป็นสิ่งที่มนุษย์เราหลงใหลเสมอมา สังเกตุได้จาก เราจำเป็นต้องอาศัยอยู่ใกล้แหล่งน้ำเพื่อให้มีชีวิตรอด ในยุคต้นของอารยธรรมมนุษย์ เรารู้ถึงความสำคัญฝน และช่วงน้ำหลากประจำปี เพื่อหลีกเลี่ยงการเกิดภัยแล้งที่จะทำให้มนุษยชาติอดอยากและล้มตาย มนุษย์ในสมัยโบราณต่างก็ใช้น้ำเป็นส่วนในพิธีกรรมทางศาสนา แต่อย่างไรก็ตาม ก็ไม่ค่อยจะมีใครพยายามที่จะเข้าใจคุณสมบัติอันพิเศษของน้ำ จนกระทั่งเมื่อเร็วๆนี้
นักวิทยาศาสตร์ชาวลอนดอน เฮนรี คาเวนดิช (Henry Cavendish) เป็นคนค้นพบไฮโดรเจน (ตอนนั้นเขาเรียกมันว่า 'phlogiston' หรือ 'inflammable air' และเขาได้รายงานว่า มันทำปฏิกิริยากับออกซิเจน เกิดเป็นน้ำ ดังนั้น จึงมีการจัดน้ำว่าเป็น สารประกอบ ไม่ใช่ "ธาตุ" ต่อมา อ็องตวน-โลร็อง เดอ ลาวัวซีเย (Antoine Lavoisier) ได้ทำการทดลองของ คาเวนดิช ขึ้นอีกครั้ง และตั้งชื่อให้ ไฮโดรเจน (มาจากภาษากรีก แปลว่า "ทำให้เกิดน้ำ") คาเวนดิช ได้ค้นพบส่วนประกอบของน้ำ (ว่าประกอบด้วยไฮโดรเจน 2 ส่วน ออกซิเจน 1 ส่วน) ในประมาณปี 1781 และส่วนประกอบนี้ได้รับการยืนยันในปี 1800 เมื่อมีการวัดปริมาณของไฮโดรเจน และออกซิเจนที่เกิดจากกระบวนการ อีเล็คโทรไลซิสของน้ำ โดย โยฮันน์ ริตเตอร์ (Johan Ritter) ซึ่งต่อมา อาเมเดโอ อาโวกาโดร (Amadeo Avogadro) ได้ยืนยันความถูกต้องของสมการนี้
2H2 + O2 → 2H2O
ในปี 1887 สวานเต อาร์เรเนียส (Svante Arrhenius) ได้อธิบาย ปฏิกิริยาไอออนไนเซซันของน้ำ (ionization of water) เป็นครั้งแรก
H2O → H+ + OH-
Svante Arrhenius (1859 – 1927) ได้รับรางวัลโนเบลสาขาเคมีในปี 1903
"Water is the driver of Nature"
Leonardo da Vinci
โมเลกุลของน้ำ มีลักษณะโค้งงอ ประกอบด้วยไฮโดรเจน 2 อะตอม และออกซิเจน 1 อะตอม ที่ไฮโดรเจนอะตอมจะมีประจุบวกเล็กน้อย ในขณะที่ออกซิเจนอะตอมจะมีประจุลบเล็กน้อย

โมเลกุลของน้ำ สามารถทำปฏิกิริยากันได้ 3 ทาง คือ ทางพันธะไฮโดรเจน (hydrogen-bonding), ทางแรงแวนเดอวาลล์ (van der Waals interactions) และแรงดึงดูดทางไฟฟ้า (electrostatic interactions) แต่ที่เกิดมากที่สุดคือ พันธะไฮโดรเจน ระหว่างโมเลกุลของน้ำ ซึ่งเป็นแรงดึงดูดปานกลางระหว่างอะตอมออกซิเจนของโมเลกุลน้ำข้างเคียง กับไฮโดรเจนอะตอมของน้ำอีกโมเลกุลนึง ดังนั้น โมเลกุลน้ำจึงสามารถประกอบกันเป็นสาย 
น้ำทุกๆโมเลกุล จะมีไฮโดรเจนอย่างน้อย 1 อะตอม ที่จับกับโมเลกุลของน้ำข้างเคียง โดยจะไม่พบว่ามีโมเลกุลของน้ำที่เป็นอิสระ โดยไม่จับกับน้ำโมเลกุลอื่นเลย
น้ำ (H2O) ประกอบด้วยไฮโดรเจนที่น้ำหนักเบา 2 อะตอม จับกับออกซิเจนอะตอมที่น้ำหนักมากกว่าถึง 16 เท่า น้ำแต่ละโมเลกุลมีค่าประจุไฟฟ้าเป็นกลาง แต่มีขั้วไฟฟ้า โดยจุดศูนย์กลางของขั้วบวกและขั้วลบอยู่คนละตำแหน่งกัน ไฮโดรเจนแต่ละอะตอม มีนิวเคลียส ซึ่งประกอบด้วย 1 โปรตอนซึ่งมีประจุบวก ล้อมรอบด้วย กลุ่มเมฆ ('cloud') ของอิเล็คตรอน 1 ตัวซึ่งมีประจุลบ ออกซิเจนอะตอม มีนิวเคลียสที่ประกอบด้วยโปรตอนที่มีประจุบวก 8 ตัว และนิวตรอนที่ไม่มีประจุ 8 ตัว ล้อมรอบด้วย กลุ่มเมฆ ('cloud') ของอิเล็คตรอนซึ่งมีประจุลบ 8 ตัว
น้ำ มีโมเลกุลที่เล็กกว่าโมเลกุลอื่นๆเกือบทุกชนิดมาก ดังนั้น ทั้งน้ำและน้ำแข็ง จึงมีความหนาแน่นของโมเลกุลสูง น้ำ 1 ลิตรที่อุณหภูมิห้อง (25 °C) หนักเกือบ 1 กิโลกรัม (997 กรัม) และมีโมเลกุลของน้ำประทาณ 33 ล้านล้านล้านล้านโมเลกุล
Hydrogen ions (ไฮโดรเจนไอออน) 
ไฮโดรเจนไอออน เป็นโมเลกุลที่มีประจุ มีสูตรเคมี คือ H3O+ เกิดจากการมีโปรตอนเพิ่มมาในโมเลกุลของน้ำ
Hydroxide ions (ไฮดรอกไซด์ไอออน) 
ไฮดรอกไซด์ไอออน เป็นโมเลกุลที่มีประจุ มีสูตรเคมี OH- เกิดจากโมเลกุลของน้ำสูญเสียโปรตอนไป
ความสัมพันธ์ทางชีวภาพ
ร่างกายมนุษย์ประกอบด้วยน้ำประมาณ 60 ถึง 70% ในวัยหนุ่มสาว และน้อยลงในวัยชรา น้ำเป็นสิ่งจำเป็นสำหรับการทำงานของกระบวนการชีวิต ใครก็ตามที่มองมนุษย์แบบองค์รวมจะต้องให้ความสำคัญกับน้ำมากที่สุด ประมาณ 1 ใน 5 ของน้ำในร่างกายมนุษย์ (เช่น น้ำหนักตัว 80 กก. มีน้ำประมาณ 50 ลิตร) พบว่าเป็นของเหลวระหว่างเซลล์ ซึ่งเรียกว่า น้ำเหลือง มากกว่าครึ่งหนึ่งเป็นน้ำในเซลล์ ส่วนที่เหลือจะพบในเลือดและในอวัยวะ หากไม่มีน้ำจะไม่มีกระบวนการชีวิตเกิดขึ้นได้
มนุษย์คือพิพิธภัณฑ์สัตว์น้ำ
น้ำเหลือง เป็นเสมือนสำเนาของมหาสมุทรดึกดำบรรพ์ ซึ่งสิ่งมีชีวิตกำเนิดขึ้นเมื่อหลายล้านปีก่อน มหาสมุทรดึกดำบรรพ์นี้เป็นทะเลเค็มที่มีความเค็ม 0.9% ซึ่งต่ำกว่าทุกวันนี้เล็กน้อย ในเวลานั้น เซลล์แต่ละเซลล์จะรวมตัวกันเป็นกลุ่มเซลล์ที่เริ่มจัดระเบียบตัวเอง และพัฒนาสติปัญญาชนิดหนึ่ง ซึ่งในที่สุดสัตว์เลี้ยงลูกด้วยนมก็โผล่ออกมา เราพบสภาพแวดล้อมของมหาสมุทรดึกดำบรรพ์นี้อีกครั้งในน้ำเหลืองของเรา ค่าของความเค็ม 0.9% เป็นที่รู้จักกันดีว่าเป็นน้ำเกลือทางสรีรวิทยา (physiological saline solution) น้ำเหลือง ล้อมรอบเซลล์ทั้งหมดและประกอบด้วยน้ำ และเกลือ, แร่ธาตุและโปรตีน มันคือ "milieu (สิ่งแวดล้อม)" ที่เซลล์ "อาศัย" และเป็นส่วนหนึ่งของเนื้อเยื่อเกี่ยวพัน หากสภาพแวดล้อมของเซลล์ไม่เหมาะสมเซลล์จะไม่สามารถพัฒนาไปในทางที่ดีได้
ดังนั้นเราสามารถเปรียบเทียบร่างกายของเรากับพิพิธภัณฑ์สัตว์น้ำ: เซลล์ร่างกายของเราเป็นสิ่งมีชีวิตในน้ำที่อาศัยอยู่ในทะเลน้ำเหลือง ซึ่งพวกมันกินอาหารด้วยตัวเอง และดูดซับของเสียจากการเผาผลาญของพวกมัน ในพิพิธภัณฑ์สัตว์น้ำ สุขภาพของ "สัตว์น้ำที่อาศัยอยู่" นั้น ขึ้นอยู่กับคุณภาพของอาหาร และความสะอาดของน้ำ ไม่มีเจ้าของตู้ปลาที่ให้ยาแก่ปลาที่ป่วย แต่เขาจะควบคุมคุณภาพของน้ำ เปลี่ยนน้ำ และให้อาหารที่ดีต่อสุขภาพ
น้ำเหลือง
ในขณะที่เลือดและการไหลเวียนเลือด เป็นที่รู้จัก และได้รับการศึกษาเป็นอย่างดี แต่ระบบน้ำเหลืองยังคงเป็นเหมือนหนังสือที่ปิดอยู่ แม้กระทั่งสำหรับแพทย์จำนวนมาก การแพทย์ "แบบเดิม" มุ่งเน้นเฉพาะ "สาร" ในตัวมนุษย์ ความผิดปกติของสิ่งมีชีวิตทั้งหมดเกิดจากอาการขาดสารอาหาร หรือการกระจาย "สาร" เหล่านี้ไม่ถูกต้อง น้ำในร่างกาย - ไม่ว่าจะอยู่ในเนื้อเยื่อเกี่ยวพัน เช่น น้ำเหลือง, ในเลือด หรือในเซลล์ ก็ถือว่าเป็นเพียง "ฟิลเลอร์" ซึ่งเป็นสารขนส่งที่เป็นกลางที่ดีที่สุด แต่ไม่ใช่ตัวพาข้อมูล และคุณสมบัติซึ่งมีคุณภาพ เป็นสิ่งสำคัญสำหรับสุขภาพของสิ่งมีชีวิตทั้งหมด
อย่างไรก็ตาม คุณภาพ, คุณสมบัติ และองค์ประกอบของน้ำเหลือง มีความจำเป็นต่อการทำงานโดยรวม, สถานะภูมิคุ้มกัน, การจัดหาสารอาหาร และการขนส่งของเสียในร่างกายของเรา มันเป็นตัวกำหนดสุขภาพของเซลล์ และอายุขัยของเซลล์ในร่างกาย ตามการทดลองของ อเล็กซิส คาร์เรล ผู้ได้รับรางวัลโนเบลสาขาการแพทย์ (2416-2487) แสดงให้เห็นว่า เขาสามารถรักษาเซลล์หัวใจไก่ไว้เป็นเวลา 28 ปี โดยการเปลี่ยนของเหลวที่ใช้เลี้ยงเซลล์ทุกวัน
โมเลกุลของน้ำในน้ำเหลือง ล้อมรอบโปรตีน และเซลล์ในร่างกายเป็นชั้นๆ งานวิจัยของเกาหลี แสดงโครงสร้างของน้ำที่ล้อมรอบโปรตีน และเซลล์ที่มีชีวิตในร่างกายเป็น 3 ชั้น:
ชั้นในสุด - ซึ่งเป็นโมเลกุลของน้ำที่แข็งแรง มีโครงสร้างคล้ายผลึกน้ำแข็งเหลว มีช่องว่างกลวงใหญ่กว่า เหมือนน้ำที่เป็น "ของเหลว"
ชั้นที่สอง ยังคงมีโครงสร้างคล้ายคริสตัลเล็กน้อย
ชั้นที่สาม สอดคล้องกับน้ำเหลือง "ปกติ" ความถี่เรโซแนนซ์ 53 เฮิรตซ์วัดด้วยวิธีเรโซแนนซ์นิวเคลียร์ เมื่อวัดเซลล์ของสิ่งมีชีวิต
ชั้นน้ำ "นอกสุด" นี้ ตามด้วยน้ำเหลือง "ปกติ" ที่มีรสเค็ม
"วัฏจักร" ของน้ำในร่างกายมนุษย์
น้ำ ผ่านปาก หลอดอาหาร และกระเพาะอาหารเข้าสู่ลำไส้เล็ก ควรดื่มในตอนเช้าก่อนเป็นอันดับแรก ซึ่งเป็นเวลาที่ดีที่สุดเพราะตอนนั้นท้องว่าง (ถ้าคุณไม่ได้กินสเต็กจานหนัก และมันในตอนเย็นมาก่อน) เซลล์ที่ผลิตกรดในกระเพาะอาหารที่อยู่บนผนังกระเพาะอาหาร ยังไม่ได้รับสัญญาณการรับรสใด ๆ จากต่อมรับรสในปาก และยัง "นอนหลับ" อยู่ ดังนั้น น้ำจึงได้รับอนุญาตให้ผ่าน pylorus (ไพลอรัส) ซึ่งเป็นเหมือนผู้เฝ้าประตู ซึ่ง "ป้องกัน" ทางออกของกระเพาะอาหารไปสู่ลำไส้ น้ำบริสุทธิ์ที่ไม่มีสารปรุงแต่งเท่านั้น ที่ไม่ทำให้ระคายเคืองต่อมรับรสในปากและไม่จำเป็นต้องได้รับการ "ย่อย" ในกระเพาะอาหาร นี่คือวิธีการน้ำผ่านเข้าไปในลำไส้เล็ก ถ้าท้องอิ่ม น้ำก็ผ่านได้เพียงเล็กน้อยเหนืออาหารจากกระเพาะที่มีสภาพเป็นกรด และไปถึงไพลอรัสโดยที่ไม่มีการเจือปนใดๆ น้ำที่เหลือจะผสมกับกรดในกระเพาะอาหาร
แบคทีเรีย "ดี" ในลำไส้เล็กจะต้องอยู่ในสภาพแวดล้อมที่ได้รับความชุ่มชื้นอย่างเพียงพอด้วยน้ำที่เป็นกลาง หรือเป็นด่างเล็กน้อย โดยเฉพาะอย่างยิ่ง ถ้าตับอ่อน (ซึ่งทำหน้าที่หลั่งสารที่เป็นด่างอย่างแรงเพื่อทำให้อาหารจากกระเพาะที่มีสภาพเป็นกรดนั้น เป็นกลาง และเพิ่มค่า pH ให้อยู่ในช่วงอัลคาไลน์) ทำหน้าที่ได้จำกัด หรือเกิดความเสียหายขึ้น (เช่นในกรณีของผู้ป่วยโรคเบาหวาน เป็นต้น) สภาพแวดล้อมของลำไส้เล็กจึงต้องการการสนับสนุนจากน้ำที่เป็นกลางหรือเป็นด่าง
น้ำจะถูกดูดซึมในลำไส้เล็กทางวิลไล (intestinal villi - ส่วนยื่นเล็กๆมากมาย เพื่อเพิ่มพื้นที่ผิวในการดูดซึมสารอาหารที่ย่อยแล้วได้อย่างมีประสิทธิภาพ) ในวิลไลเหล่านี้มีเส้นเลือดและท่อน้ำเหลืองตั้งอยู่ในแนวขนานใต้เยื่อเมือกที่ซึมผ่านได้ ที่น่าสนใจคือ เยื่อบุลำไส้มีกระแสไฟฟ้าในเชิงบวก (ประจุบวก) จึงดึงดูดโมเลกุลที่มีประจุลบ และผลักไล่โมเลกุลที่มีประจุบวก
อาหารที่มาจากพืช และอาหารประเภทผัก ซึ่งเป็นอาหารดึกดำบรรพ์ของมนุษย์ มีประจุลบ
จึงสามารถถูกดึงดูดโดยประจุบวกของเยื่อบุลำไส้ และยังสามารถอธิบายได้อีกว่า เหตุใดแร่ธาตุอัลคาไลน์ซึ่งมีประจุบวกที่ละลายอยู่ในน้ำ เช่น แคลเซียม (Ca ++) หรือแมกนีเซียม (Mg ++) ในน้ำแร่ ไม่สามารถดูดซึมได้ แร่ธาตุเหล่านี้จะสามารถดูดซึมได้ก็ต่อเมื่อ ถูกฝังอยู่ในโมเลกุลอินทรีย์
ผ่านเยื่อบุลำไส้ที่ซึมผ่านได้ น้ำตาล และกรดอะมิโน จะถูกดูดซึม และเคลื่อนย้ายไปทางเส้นเลือด น้ำ และไขมัน จะถูกดูดซึม และขนส่งโดยท่อน้ำเหลือง น้ำตาล และกรดอะมิโนจะผ่านหลอดเลือดดำพอร์ทัลไปยังตับ ซึ่งสารพิษจะถูกกรองออก น้ำ และไขมันจะผ่านต่อมน้ำเหลือง (ซึ่งจะกรองสารพิษ และกรดออก) เข้าไปในท่อเต้านม ซึ่งจะถูกป้อนเข้าสู่หลอดเลือดดำด้านซ้าย และเข้าสู่กระแสเลือด ด้วยวิธีนี้น้ำจะกลายเป็นซีรั่มในเลือด และ "เจือจาง" เลือด หลังจากนั้น ผ่านการแลกเปลี่ยนในเส้นเลือดฝอย มันจะกลับคืนสู่ร่างกายเป็นน้ำเหลือง
เมื่อเข้าใจกระบวนการเหล่านี้จะเห็นได้ชัดเจนว่า
• ต่อมน้ำเหลืองในช่องท้อง มีความสำคัญต่อระบบภูมิคุ้มกัน
• จะมีผลดีต่อระบบภูมิคุ้มกัน เมื่อดื่มน้ำเป็นน้ำที่เป็นกลาง หรือเป็นด่างเล็กน้อย
• pH ของน้ำดื่มมีผลต่อ pH ของน้ำเหลือง และซีรั่มในเลือด
• แร่ธาตุอนินทรีย์ที่ละลายในน้ำ ดูดซึมยาก หรือไม่สามารถดูดซึมได้
ในความสมดุลของน้ำในร่างกาย เราต้องไม่ลืมว่า "น้ำภายใน" หรือน้ำออกซิเดชั่น ซึ่งผลิตขึ้นระหว่างการผลิตพลังงานในไมโตรคอนเดรีย โดยการหลอมรวมของไฮโดรเจนและออกซิเจน - สำหรับผู้ใหญ่จะมีปริมาณประมาณ 300 มิลลิลิตร/วัน
"ระบบ" ขนส่ง ในร่างกาย
โดยพื้นฐานแล้วระบบขนส่งในร่างกายมนุษย์มี 2 ประเภท:
Active transport เกิดขึ้นทางเลือด ควบคุมและเต้นเป็นจังหวะโดยหัวใจ (ความจริงที่ว่าหัวใจไม่ใช่ปั๊ม ไม่เพียงแต่ได้รับการยืนยันจากการคำนวณประสิทธิภาพเท่านั้น แต่ยังได้รับการยืนยันจากการวิจัยทางวิทยาศาสตร์เมื่อเร็ว ๆ นี้ ซึ่งแสดงให้เห็นผ่านรูปแบบการไหลของหัวใจที่มีชีวิตซึ่งเลือดในหัวใจไหลเป็นกระแสน้ำวนในทุกระยะ และไม่ได้ "บีบ" ผ่านหลอดเลือดแดงด้วยพลังของกล้ามเนื้อหัวใจ) เลือดจะกระจายน้ำตาล, ออกซิเจน, ฮอร์โมน, สารสื่อต่างๆ ฯลฯ ไปทั่วร่างกาย เลือด ประกอบด้วยซีรั่มที่เกิดจากน้ำเหลืองเป็นส่วนใหญ่ และจะถูกส่งกลับมาที่น้ำเหลืองดังเดิม
ถัดจากเซลล์เม็ดเลือดแดงที่มีออกซิเจน เลือดยังมีเซลล์เม็ดเลือดขาว ซึ่งทำหน้าที่ "ตำรวจของร่างกาย" สามารถสร้างอนุมูลอิสระหากจำเป็น เช่น ระหว่างการติดเชื้อ - ออกซิไดซ์แบคทีเรีย หรือไวรัสที่แปลกปลอม และเป็นอันตราย (ปล้นอิเล็กตรอนจากเชื้อโรค แล้วเผาไหม้มัน) จากทางเลือด "ความฉลาดของร่างกาย" สามารถกระจายสารส่งสารจากต่อมไร้ท่อไปทั่วร่างกายได้ในเวลาอันรวดเร็ว - เช่น ฮอร์โมนความเครียด. ฮอร์โมนแห่งความสุข และอื่น ๆ
ผ่านทางเลือด สารทั้งหมดเหล่านี้จะถูกนำเข้าสู่เส้นเลือดฝอย เส้นเลือดที่บางที่สุดและดีที่สุด ซึ่งสามารถให้สารซึมผ่านได้ เหมือนเยื่อบุลำไส้ ทำให้ออกซิเจน, สารอาหาร, ฮอร์โมน ฯลฯ ผ่านเข้าไปในช่องว่างระหว่างเซลล์ และน้ำเหลือง และไปถึงเซลล์ของร่างกาย ของเสียที่เป็นก๊าซ โดยเฉพาะอย่างยิ่ง CO2 จะถูกดูดซึมโดยเลือด และขนส่งไปยังปอด หากคุณเข้าไปในห้องนอนในตอนเช้า หลังจากที่มีคนนอนในห้องนอนโดยปิดหน้าต่าง คุณจะได้กลิ่นของก๊าซเปรี้ยวที่ถูกขับออกมาในตอนกลางคืน
น้ำเหลือง ไหลผ่านช่องว่างระหว่างเซลล์โดยเป็นส่วนที่ 2 ของห่วงโซ่การขนส่ง และเป็น "ไมล์สุดท้าย" ไปยังปลายทาง คือ เซลล์ของร่างกาย รวมถึงการกำจัดของเสียที่เกิดในเซลล์และในเนื้อเยื่อ นี่คือการขนส่งแบบ passive transport กล่าวคือ ไม่มีการไหลผ่านช่องทางของสาร, ไม่มีตัวพา แต่การกระจายของสารเกิดขึ้นตาม กฎการแพร่กระจาย และการทำให้เท่าเทียมกันของความเข้มข้น ซึ่งหมายความว่า พวกมันเคลื่อนจากที่ที่มีความเข้มข้นสูงไปยังที่ที่ความเข้มข้นต่ำ จนกว่าความเข้มข้นจะเท่ากัน นอกจากน้ำแล้ว น้ำเหลืองยังประกอบด้วยเกลือ และโปรตีนที่ละลายในสัดส่วนที่แตกต่างกัน ขึ้นอยู่กับส่วนของร่างกาย ยิ่งน้ำเหลืองมีความเป็นกรดมากเท่าไหร่ โปรตีนที่มีอยู่ก็จะมีลักษณะเป็นเจลมากขึ้นเท่านั้น โปรตีนที่มีลักษณะคล้ายเจล จะส่งผลต่อความลื่นไหล และการซึมผ่านของน้ำเหลืองสำหรับกระบวนการแพร่กระจาย
เมื่อพูดถึง "hyperacidity" ซึ่งมักจะเป็นสาเหตุของโรคทั้งหมด ไม่มากก็น้อย จะเห็นได้ชัดว่า "hyperacidity" นี้หมายถึง ค่า pH ในเนื้อเยื่อเกี่ยวพัน และในระบบน้ำเหลืองโดยเฉพาะเนื่องจาก "ความเป็นกรด" ไม่ใช่ "ไม่ดี" แต่เป็นสิ่งที่จำเป็น และสำคัญในอวัยวะ และในบางส่วนของร่างกายเรา
80% ของน้ำเหลือง อยู่ในช่องท้องบริเวณกระเพาะอาหาร เนื่องจากที่นี่มีอาหารอยู่ สารแปลกปลอมส่วนใหญ่ และสารที่เป็นอันตรายต่อสุขภาพร่างกายมากที่สุด ก็อยู่ในบริเวณนั้นด้วย ในช่องท้อง เป็นที่ตั้งของศูนย์กลางของระบบภูมิคุ้มกันและสุขภาพของเรา - ลำไส้ที่แข็งแรงซึ่งสามารถย่อยอาหารได้โดยไม่เกิดการผลิตแอลกอฮอล์ขึ้นในร่างกาย, ไม่เกิดกระบวนการหมักและการสลายตัว จึงมีความสำคัญสูงสุด ไม่เพียงแต่ต่อสุขภาพโดยรวมเท่านั้น แต่ยังรวมถึง การทำงานของระบบภูมิคุ้มกันเพื่อป้องกันโรคภูมิแพ้ ฯลฯ
เซลล์ร่างกายของเรา ไม่มีช่องทางเชื่อมตรงกับเส้นเลือดฝอย เช่นเดียวกับที่ที่ดินของคุณไม่มีทางเข้าถึงทางหลวงโดยตรง ส่งผลให้ความเข้มข้นของออกซิเจน, สารอาหาร และน้ำตาลเพิ่มขึ้นในเนื้อเยื่อเกี่ยวพัน และน้ำเหลืองรอบ ๆ เส้นเลือดฝอย ในขณะที่รอบ ๆ เซลล์มีความเข้มข้นของกรดคาร์บอนิก (คาร์บอนไดออกไซด์ C02 ที่ละลายในน้ำ) และของเสียอื่น ๆ จากการเผาผลาญของเซลล์เพิ่มขึ้น ในขณะที่เซลล์ใช้ออกซิเจน และน้ำตาล suction effect และการไล่ระดับความเข้มข้นจะค่อยๆเกิดขึ้น ออกซิเจน และสารอาหาร จะเคลื่อนย้ายไปยังเซลล์ ในขณะที่ก๊าซคาร์บอนไดออกไซด์ และกรดก๊าซอื่น ๆ จะเคลื่อนย้ายไปยังเส้นเลือดฝอย และถูกดูดซึมโดยเลือด และเคลื่อนย้ายออกไปเพื่อให้หายใจออกผ่าน ปอด
ของเสีย และสารตกค้างอื่น ๆ ของการเผาผลาญของเซลล์ จะค่อยๆถูกส่งเข้าไปในระบบน้ำเหลือง และท่อของมัน ซึ่งพวกมันจะละลายในน้ำเหลือง และเคลื่อนที่โดยการบีบตัวเบา ๆ ของกล้ามเนื้อโดยรอบ และถูกทำความสะอาดโดยต่อมน้ำเหลือง และส่งกลับเข้าไปในกระแสเลือดผ่านทาง superior vena cava การไหลเวียนของเลือด - น้ำเหลือง - เลือด จึงเสร็จสมบูรณ์ การทำงานของห่วงโซ่การขนส่งเหล่านี้ มีความสำคัญต่อสุขภาพ, อายุที่ยืนยาว และประสิทธิภาพของเซลล์
อเล็กซิส คาร์เรล ผู้ได้รับรางวัลโนเบลทางการแพทย์ ผู้ซึ่งรักษาหัวใจไก่ไว้เป็นเวลา 28 ปีด้วยการเปลี่ยนสารละลายสารอาหารโดยรอบเซลล์เป็นประจำกล่าวว่า:
"เซลล์เป็นอมตะ มีเพียงของเหลวที่อยู่รอบเซลล์ ที่ย่อยสลายได้ โดยการแทนที่ของเหลวนี้เป็นประจำ เราจะให้สิ่งที่เซลล์ต้องการ เพื่อหล่อเลี้ยงตัวเอง และเท่าที่เราทราบชีวิตสามารถดำเนินต่อไปได้อย่างไม่มีกำหนด "
เมื่อเข้าใจกระบวนการเหล่านี้จะเห็นได้ชัดเจนว่า
• การขนส่งแบบพาสซีฟ (passive transport)ในน้ำเหลือง มีหน้าที่สำคัญในร่างกาย
• น้ำเหลืองที่มีค่า pH ต่ำ จะมีความหนืด และมีลักษณะคล้ายเจลมากกว่า เนื่องจากโปรตีนที่จับตัวเป็นก้อนมากกว่าน้ำเหลืองที่มีค่า pH สูง
• ความสม่ำเสมอ และความลื่นไหลของน้ำเหลือง มีผลโดยตรงต่อการจัดหาสารอาหารให้เซลล์และกำจัดของเสียออกจากเซลล์
อัลคาไลน์และกรด: ระบบย่อยอาหาร
อาหารที่เรากินนั้น ผ่านกระบวนการของแบคทีเรียในระบบย่อยอาหาร ในลักษณะที่จะทำให้สารที่จำเป็นต่อร่างกาย สามารถดูดซึมได้โดยเยื่อเมือกขนาดเล็กในลำไส้ ดังนั้นแบคทีเรียหลายล้านล้านชนิดจึงอาศัยอยู่ร่วมกันกับเราอย่างมีนัยทางชีวภาพ
แบคทีเรียแต่ละชนิดต้องการสภาพแวดล้อมที่เหมาะสม ทั้งในด้านอุณหภูมิ, pH, ความชื้น
ซึ่งจะสามารถเจริญเติบโต และทำงานได้ดีที่สุด ระบบย่อยอาหารของเราได้รับการออกแบบมา เพื่อให้แบคทีเรียที่มีความสำคัญต่อกระบวนการย่อยอาหารตามลำดับ มีที่อยู่อาศัยที่เหมาะสม
ระบบย่อยอาหารจึงแบ่งออกเป็นสี่ส่วนด้วยค่า pH ที่แตกต่างกัน:
- ช่องปาก เป็นอวัยวะที่มีแบคทีเรียอาศัยอยู่หนาแน่นที่สุดในร่างกาย ซึ่งควรจะเป็น
อัลคาไลน์เล็กน้อย เพื่อให้แบคทีเรียที่ดีพัฒนาได้ดี และกักเก็บแบคทีเรียที่ไม่ดีเอาไว้
เช่น แบคทีเรียที่ก่อให้เกิดโรคฟันผุ ดังนั้น น้ำลายควรเป็นด่างเล็กน้อย ซึ่งจะเป็นได้
ถ้าของเหลวในน้ำเหลืองเป็นด่าง และมีเอนไซม์อัลคาไลน์ซึ่งใช้ผลิตน้ำลาย - กระเพาะอาหาร เป็นกรดมาก pH ต่ำ และปริมาณคลอรีนสูง ช่วยในการย่อยสลาย
โปรตีน และ "ฆ่าเชื้อ" อาหารโดยการฆ่าแบคทีเรียที่มาจากอาหาร, เชื้อรา และจุลินทรีย์อื่น ๆ ในการให้ได้ค่า pH ที่เป็นกรดข้างมากนี้ parietal cells บนผนังกระเพาะอาหาร จะนำคลอรีน (Cl) จากNaCI (เกลือ) ที่ละลายอยู่ในเลือด มาผลิตเป็น กรดไฮโดรคลอริก (HCI) ซึ่งมีค่า pH ประมาณ pH 2 - ลำไส้เล็ก ควรเป็นด่างอีกครั้ง เพื่อที่จะสามารถเป็นที่อยู่อาศัยสำหรับแบคทีเรียที่ชอบด่าง ซึ่งทำหน้าที่ย่อยสลายอาหาร ในลำไส้เล็ก แบคทีเรียทำหน้าที่หลัก คือ ย่อยอาหาร และเพื่อที่จะทำให้อาหารที่มาจากกระเพาะเป็นกลาง จะมีการหลั่งสารจากท่อน้ำดี, ตับ
และตับอ่อน ไปสู่การย่อยอาหารของลำไส้เล็ก และนำสารคัดหลั่งที่เป็นด่าง ซึ่งตับอ่อนผลิตคือ โซเดียม ไฮดรอกไซด์ (NaOH) ซึ่งผลิตจากโซเดียมในเลือด - ลำไส้ใหญ่ เป็นกรดเล็กน้อยอีกครั้ง เป็นที่ที่แร่ธาตุถูกดูดซึมผ่านเยื่อเมือก และแบคทีเรียที่ตาย จะถูกทำให้เป็นกลาง และถูกย่อยโดยแบคทีเรียอื่น ๆ
จัดหาสารอาหารและกำจัดของเสียในเซลล์ร่างกาย
เช่นเดียวกับสิ่งมีชีวิตเซลล์เดียวที่อาศัยอยู่ในน้ำ สุขภาพของเซลล์เราขึ้นอยู่กับของเหลวโดยรอบเป็นหลัก นอกเหนือจากงานเฉพาะด้านแล้ว การผลิตพลังงานเป็นหน้าที่หลักของเซลล์ สิ่งที่เราเรียกว่า “ชีวิต” เกิดขึ้นในเซลล์ การผลิตพลังงาน เกิดขึ้นใน 1,000 ถึง 6,000
ไมโทคอนเดรีย ซึ่งมีอยู่ในทุกๆเซลล์ของร่างกาย ซึ่งเป็นสถานีพลังงานของร่างกาย ภายใน
ไมโทคอนเดรีย ไฮโดรเจน ถูกสกัดจากคาร์โบไฮเดรต และกรดไขมันที่เรียกว่า "วงจรกรดซิตริก" ไฮโดรเจน ถูกเก็บไว้ในโคเอนไซม์ NADH แล้วถูกออกซิไดซ์ด้วยออกซิเจน ซึ่งจะแพร่กระจายจากน้ำเหลืองเข้าสู่เซลล์ ผ่านช่องทางในผนังเซลล์ การเกิดออกซิเดชันนี้ ก่อให้เกิดพลังงาน (เช่นเดียวกับในเซลล์เชื้อเพลิง) ที่ชาร์จเอนไซม์ AMP (อะดีโนซีนโมโนฟอสเฟต) ให้เป็น ATP (อะดีโนซีนไตรฟอสเฟต) ซึ่งกระจายพลังงานไปทั่วเซลล์ และเปลี่ยนกลับเป็น AMP เหมือนเดิม การเกิดออกซิเดชันนี้ยังก่อให้เกิดสิ่งที่เรียกว่า endogenous water หรือน้ำออกซิเดชั่น ซึ่งมีส่วนช่วยในการจ่ายน้ำให้กับเซลล์
คาร์บอนจากคาร์โบไฮเดรต (กลายเป็นกรดคาร์บอนิก เมื่อรวมกับน้ำ) ซึ่งไม่จำเป็นอีกต่อไป และสิ่งสกปรกอื่น ๆ ทั้งหมดที่เข้าสู่เซลล์ พร้อมด้วยคาร์โบไฮเดรต และกรดไขมัน คือสิ่งที่เรียกว่า "ตะกรัน" หรือ สารพิษที่ไม่ระบุรายละเอียดในการแพทย์ทางเลือก พวกนี้ทำให้
pH ภายในเซลล์ลดต่ำลง ดังนั้น ในเซลล์ที่ทำงาน น้ำในเซลล์จึงมีความเป็นกรดเล็กน้อยเสมอ อย่างไรก็ตาม กรดเหล่านี้จะต้องถูกกำจัดออกอย่างต่อเนื่อง เพื่อไม่ให้ความเข้มข้นของกรดในเซลล์เพิ่มขึ้นสูงเกินไป สำหรับการทำให้ความเป็นกรดลดลง กรดจะถูกขนส่งผ่านช่องทางผ่านผนังเซลล์เข้าไปในของเหลวในเนื้อเยื่อเกี่ยวพัน เพื่อป้องกันไม่ให้เซลล์ขาดน้ำ น้ำในเซลล์จะต้องถูกแทนที่ ดังนั้น น้ำสะอาดที่เป็นด่างเล็กน้อยควรกลับเข้าสู่เซลล์ได้ง่ายที่สุด
น้ำนี้ไปยังเซลล์โดยช่องทางน้ำพิเศษที่เรียงรายไปด้วย aquaporins ซึ่งเป็นโปรตีนรูปเกลียว, มีประจุบวก อนุญาตให้โมเลกุลของน้ำที่มีประจุลบเท่านั้นผ่านเข้าสู่เซลล์ และป้องกันน้ำที่มีประจุในเชิงบวก และพลังงานต่ำ ซึ่งจะทำให้พลังงานไฟฟ้าที่สร้างขึ้นในเซลล์ลดลง ไม่ให้ผ่านได้ ในปี 2546 นายแพทย์ชาวอเมริกัน Peter Agre ได้รับรางวัลโนเบลสาขาเคมี สำหรับ
งานวิจัยของเขาเกี่ยวกับหน้าที่ของ aquaporins
ดังนั้น เซลล์อาจขาดน้ำได้ แม้ว่าจะมีน้ำเพียงพอในเนื้อเยื่อเกี่ยวพัน หากน้ำในเนื้อเยื่อเกี่ยวพันนี้มีประจุบวก ในเซลล์ที่แห้ง ขาดน้ำ สารพิษจะไม่สามารถถูกกำจัดออกไปได้อย่างเหมาะสม เมื่อเวลานานขึ้น เซลล์จะกลายเป็นกรด และการผลิตพลังงานลดลง เนื่องจากมีออกซิเจนไม่เพียงพอสำหรับการเผาไหม้ เนื่องจากถูกกรดส่วนเกิน "กลืนกิน" เข้าไป
หากเซลล์มีความเป็นกรดมากเกินไปอย่างต่อเนื่อง และมีออกซิเจนน้อยเกินไปอย่างถาวร
น้ำตาลที่มีอยู่ จะเริ่มเกิดการหมัก และเซลล์จะเปลี่ยนการเผาผลาญจากแอโรบิค
(ต้องการออกซิเจน) เพื่อผลิตพลังงาน เป็นแบบไม่ใช้ออกซิเจน ในสถานะนี้ กลไกการควบคุมตามธรรมชาติของเซลล์จะถูกลบล้าง และเริ่มเติบโตอย่างไม่สามารถควบคุมได้ - นั่นคือ ขั้นตอนแรกของการพัฒนาเป็นมะเร็ง
เมื่อเข้าใจกระบวนการเหล่านี้จะเห็นได้ชัดเจนว่า
- เซลล์จะสร้างตะกรันที่เป็นกรดหรือ "สารพิษ" เสมอ
- สภาพแวดล้อมของเซลล์ในภาวะอัลคาไลน์เท่านั้น ที่สามารถดูดซับตะกรันที่เป็นกรดเหล่านี้ออกจากเซลล์ได้อย่างเหมาะสม
- เซลล์จะแห้ง ขาดน้ำ ถ้าไม่มีน้ำ "ดี" ที่มีประจุลบ อยู่รอบ ๆ
- การหมักเซลล์ (cell fermentation) ซึ่งถูกระบุว่าเป็นสาเหตุของมะเร็งโดย Otto Warburg ผู้ได้รับรางวัลโนเบลในปี 1967 เกิดจากน้ำเหลืองที่มีความเป็นกรด
การใช้น้ำในร่างกาย
น้ำไม่ได้กระจายอย่างสม่ำเสมอในร่างกาย ปริมาณน้ำในดวงตา มีถึง 96% ในฟัน 10% ในน้ำเหลืองประมาณ 90% ในเลือดประมาณ 88%
จะเห็นได้ชัดว่าอวัยวะที่ "มีชีวิต" และ "concious" จะมีน้ำเป็นเปอร์เซ็นต์สูง ในขณะที่ในอวัยวะที่ "ตาย" และทำงานโดยไม่รู้สึกตัว มีปริมาณน้ำอยู่ในระดับต่ำ
การกระจายตัวของน้ำในร่างกาย แสดงให้เห็นว่า น้ำเป็นพาหะของชีวิต และความรู้สึกตัว หรืออย่างน้อยก็จำเป็นสำหรับการมีชีวิตอยู่!
บทเสริม : ประวัติศาสตร์ของวิวัฒนาการ
จากรุ่นสู่รุ่น พันธุกรรมของมนุษย์เปลี่ยนไปเพียงเล็กน้อยต่อหนึ่งพันช่วง พันธุกรรมของเราส่วนใหญ่มาจากยุคหิน เป็นเวลาหลายแสนปีแล้วที่ Homo sapiens อาศัยอยู่ในถ้ำหรือในป่า
กิจวัตรประจำวันของนักล่า หรือมนุษย์ในยุคหินนั้นค่อนข้างเรียบง่าย: ในตอนเช้า การดื่มน้ำเป็นสิ่งแรกที่ต้องทำ ดังนั้น ถ้ำ หรือที่พักอาศัย จึงต้องตั้งอยู่บนลำธาร หรือร่องน้ำเพื่อให้มีน้ำเพียงพอ หลังจากนั้น อาหารสำหรับวันนั้น จะต้องถูกรวบรวม หรือล่าด้วยความพยายามทางร่างกายอย่างสูง สำหรับไว้รับประทานจนถึงตอนเที่ยง (อย่างเร็วที่สุด) แต่โดยปกติจะเป็นตอนเย็นเท่านั้น สมัยนั้น ไม่มีรายการโทรทัศน์ หรือรายการวัฒนธรรม - ก็เป็นเวลาสำหรับการนอนหลับ
คำแนะนำ: ลำดับการบริโภคอาหาร
กระบวนการหมัก (Fermentation)ในกระเพาะอาหาร และลำไส้เป็นสาเหตุของอาการทางร่างกายต่างๆมากมาย สาเหตุหลักมาจาก การผสมอาหารและลำดับการรับประทานอาหารที่ไม่ถูกต้อง สิ่งสำคัญคือ ต้องกินอาหารที่ "ย่อยเร็ว" นั่นคือ อาหารที่ผ่านกระเพาะอาหาร และลำไส้ในเวลาอันสั้น ก่อนกินอาหารที่ต้องย่อยในกระเพาะอาหารและลำไส้นาน
ลำดับการบริโภคอาหารควรเป็น: คาร์โบไฮเดรต ก่อนโปรตีน ก่อนไขมัน และเคี้ยวให้ดีก่อนที่จะกลืนลงไปอย่างรวดเร็ว ตัวอย่างเช่น หากคุณกินสลัดผลไม้ หลังจากกินเนื่อย่างติดมันราดด้วยซอสที่มีน้ำมัน ผลไม้จะถูก "ขัง" ไว้นานถึง 9 ชั่วโมง ที่อุณหภูมิการหมักที่เหมาะสมหลังเนื้อสัตว์ - ผลที่ตามมา คือ : กรดและแอลกอฮอล์จะเกิดขึ้น ซึ่งจะทำให้สำไส้เล็กเป็นกรด และอาจนำไปสู่ระดับแอลกอฮอล์ในเลือดได้
ปฏิกิริยาออกซิเดชั่นและรีดักชั่น
การออกซิเดชั่นและการรีดักชั่น เป็นปฏิกิริยาที่สำคัญที่สุดในระบบชีวภาพ การออกซิเดชั่นและการรีดักชั่นของโมเลกุล และการไหลของอิเล็กตรอน = พลังงาน เป็นรากฐานของชีวิตมนุษย์ทุกคน และรวมถึงชีวิตโดยทั่วไปด้วย ในทางเคมี การเกิดออกซิเดชัน หมายถึง การปลดปล่อยอิเล็กตรอน (เช่นโลหะที่เป็นสนิม) การเกิดรีดักชั่น หมายถึง การได้รับอิเล็กตรอน
Oxidation = การสูญเสียอิเล็กตรอน Reduction = การได้รับอิเล็กตรอน
การออกซิเดชั่น และการรีดักชั่น จะเกิดขึ้นพร้อมกันเสมอ ความสามารถของสารในการปลดปล่อย หรือรับอิเล็กตรอน เรียกว่า ศักยภาพการรีดอกซ์ (redox potential) การปลดปล่อยอิเล็กตรอน (ออกซิเดชั่น) ทำให้มีการปลดปล่อยพลังงานออกจากออกซิไดซ์โมเลกุล - ศักยภาพในการรีดอกซ์ของมัน จะกลายเป็นบวกมากขึ้น การรับของอิเล็กตรอน (รีดักชั่น) จะเก็บพลังงานไว้ใน reduced molecule - ศักยภาพในการรีดอกซ์ของมันจะกลายเป็นลบมากขึ้น
ศักยภาพการรีดอกซ์ของสารวัดเป็น mV (มิลลิโวลต์) - ค่าลบ หมายถึง ประจุลบส่วนเกิน = อิเล็กตรอน = พลังงาน ค่าบวก หมายถึง ประจุบวกส่วนเกิน = ขาดอิเล็กตรอน = ไม่มีพลังงาน
ปฏิกิริยารีดอกซ์ในร่างกายของเรา - พื้นฐานของชีวิต
มนุษย์เป็นสิ่งมีชีวิตทางชีวภาพ อิเล็กตรอน เป็นตัวควบคุม และเปิดใช้งานกระบวนการและปฏิกิริยาในร่างกายทั้งหมด ทุกกระบวนการในร่างกาย ไม่เพียงแต่การผลิตพลังงานเท่านั้น ทั้งหมดเป็นปฏิกิริยาออกซิเดชั่น - รีดักชัน เนื่องจากอิเล็กตรอนถูกส่งผ่านจากโมเลกุลหนึ่งไปยังอีกโมเลกุลหนึ่ง โดยทำการรีดิวซ์ก่อนแล้วจึงออกซิไดซ์ใหม่ทุกโมเลกุล ทุกการเคลื่อนไหว, ทุกความคิด, ทุกกระบวนการในร่างกายของเรา ตั้งแต่การหายใจ จนถึงการสั่น จากการเคลื่อนไหวของลำไส้ ไปจนถึงการหดตัวของกล้ามเนื้อ จากการเต้นของหัวใจไปจนถึงการพูด เกิดจากสัญญาณไฟฟ้าที่เล็ดลอดออกมาจากเซลล์ของร่างกาย ไม่ว่าจะเป็นการเคลื่อนไหวที่ควบคุมได้และรู้ตัว เช่น การมองเห็น, การได้ยิน, การรู้สึก, การรับรส หรือการเคลื่อนไหวที่เราควบคุมไม่ได้ เช่น การเต้นของหัวใจ หรือการควบคุมอวัยวะย่อยอาหาร, ต่อมน้ำลาย, กระเพาะอาหาร, การทำงานของตับอ่อน, ตับ ฯลฯ สัญญาณเหล่านี้ จะคอยทำให้มั่นใจได้ว่า ทุกอวัยวะ, ทุกต่อม, ทุกเซลล์ และทุกกล้ามเนื้อที่เกี่ยวข้อง ทำหน้าที่ได้ถูกต้อง และผลิต "สารคัดหลั่ง" ที่ถูกต้อง ในเวลาที่เหมาะสม
การเปลี่ยนแปลงพลังงานในร่างกาย
เนื่องจากเรารับประทานพลังงานที่มีพันธะทางเคมี เช่น คาร์โบไฮเดรต และน้ำตาล, ไขมันหรือโปรตีน แต่ต้องการพลังงานไฟฟ้าชีวภาพ เพื่อดำรงชีวิต เราจึงสามารถเรียกตัวเองว่า "ไฮบริด" โดยเผาพลังงานเคมีเป็น "เชื้อเพลิง" เพื่อผลิตพลังงานไฟฟ้าชีวภาพที่จำเป็นสำหรับการทำงานของร่างกาย
ก่อนที่เราจะบริโภค คาร์โบไฮเดรด, น้ำตาล, ไขมัน และโปรตีน จะถูกผลิตขึ้นใน คลอโรฟิลล์ ของพืช โดยใช้น้ำ (H2O), คาร์บอนไดออกไซด์ (CO2) และแร่ธาตุจากดิน ปฏิกิริยาเหล่านี้เกิดขึ้นโดยอาศัย พลังงานโปรตอน จากแสงแดด ซึ่งจะปล่อยออกซิเจน (O2) ออกมา โมเลกุลของคาร์โบไฮเดรต, น้ำตาล, ไขมัน และโปรตีนที่ผลิตได้ จึงมีพลังงาน (อิเล็กตรอน) มากกว่า CO2 และ H2O ที่มาจากแหล่งกำเนิด พวกมันได้ถูกรีดิวซ์ เนื่องจากดูดซับอิเล็กตรอนไว้
ในมนุษย์และสัตว์เลี้ยงลูกด้วยนม การเปลี่ยนสารเคมีเป็นพลังงานไฟฟ้าชีวภาพ จะเกิดขึ้นใน ไมโทคอนเดรีย ในเซลล์ร่างกาย ที่นั่น โมเลกุลของน้ำตาล และไขมัน จะถูกย่อยสลายในวัฏจักรของกรดซิตริก (citric acid cycle) เพื่อปลดปล่อยไฮโดรเจน (H) ที่มีอยู่ออกมา จากนั้นไฮโดรเจนจะทำปฏิกิริยากับออกซิเจน (O) ในกระบวนการหลายขั้นตอน (ซึ่งคล้ายกับเซลล์เชื้อเพลิง) เพื่อสร้างน้ำ ในระหว่างกระบวนการนี้ พลังงาน (อิเล็กตรอน) จะถูกปลดปล่อยออกมา อิเล็กตรอนเหล่านี้ จะชาร์จเอนไซม์อะดีโนซีนโมโนฟอสเฟต (AMP) ให้กลายเป็นอะดีโนซีนไตรฟอสเฟตที่มีประจุไฟฟ้าลบ (ATP) ซึ่งมีอิเล็กตรอนส่วนเกิน และทำหน้าที่เป็น "สาร" นำพลังงานไปยังสถานที่ในเซลล์ที่ต้องการ
วัฏจักรของชีวิต: ในคลอโรฟิลล์ของพืช แป้ง / น้ำตาล และออกซิเจน ถูกผลิตขึ้นจากน้ำและคาร์บอนไดออกไซด์ ด้วยความช่วยเหลือของพลังงานแสงอาทิตย์ ในไมโทคอนเดรีย ไฮโดรเจนถูกดึงออกมาจากน้ำตาล และมันจะทำปฏิกิริยากับออกซิเจน ได้น้ำ และปล่อยพลังงานที่เก็บไว้ออกมา
ออกซิเจน
ออกซิเจน เป็นสิ่งที่ขาดไม่ได้สำหรับกระบวนการสร้างพลังงาน เนื่องจากพลังงานถูกสร้างขึ้นผ่านการออกซิเดชั่นของไฮโดรเจนที่ได้จากอาหาร และทำให้เกิดน้ำขึ้น น้ำ สามารถเรียกได้ว่าเกิดจาก "ไฮโดรเจน 2 ตัว ที่ถูกออกซิไดซ์" หน้าที่ของออกซิเจน คือ การปลดปล่อยพลังงาน (อิเล็กตรอน) ที่เก็บไว้ - ไม่ว่าสิ่งนี้จะเกิดขึ้นในกระบวนการที่มีการควบคุม และอ่อนโยน อย่างเช่นในไมโตคอนเดรีย หรือเกิดในกระบวนการที่รุนแรง และร้อนรนเหมือนอยู่ในกองไฟ ออกซิเจน เป็นตัวออกซิไดซ์ที่สำคัญที่สุดสำหรับกระบวนการทางชีวภาพ ความเข้มข้นของออกซิเจนในบรรยากาศ คือ 21% ซึ่งเป็นไปอย่างเหมาะสม และสมดุลอย่างแม่นยำสำหรับชีวิตบนโลก
หากปริมาณออกซิเจนในอากาศต่ำ จะยับยั้งกระบวนการออกซิเดชั่น รวมถึงการมีชีวิต ออกซิเจนในความเข้มข้นที่สูงขึ้น กระบวนการออกซิเดชั่น และการเผาไหม้จะเกิดขึ้นโดยธรรมชาติ และสิ่งที่ไหม้เกรียมจะถูกทิ้งไว้เบื้องหลัง อย่างที่เราเห็น ออกซิเจน มีบทบาทหลายอย่าง: ในด้านหนึ่ง คือ มีความสำคัญต่อชีวิต เพราะด้วยความช่วยเหลือของออกซิเจน ไฮโดรเจนที่ได้จากโมเลกุลของสารอาหาร จึงจะสามารถถูกออกซิไดซ์ เพื่อปลดปล่อยพลังงานที่มีอยู่ ในทางกลับกัน เหมือนกับสารออกซิไดซ์อื่น ๆ มันจะทำลายโมเลกุลอื่น ๆ แต่หากไม่มีออกซิเจน ก็ไม่มีชีวิต และสิ่งมีชีวิตชั้นสูง
ในอากาศ ออกซิเจนค่อนข้างคงที่ เนื่องจากมีอยู่เป็นโมเลกุล O2 และอะตอมทั้งสองของมันรวมตัวกันเป็น electron shell ในร่างกาย ออกซิเจนจะถูกดูดซึมโดยปอด ส่งผ่านถุงลมปอด เข้าสู่เลือด จากนั้นผ่านเนื้อเยื่อเกี่ยวพัน เข้าสู่เซลล์ร่างกายที่ซึ่งจำเป็นสำหรับการผลิตพลังงาน เฉพาะในการเผาผลาญแบบ แอโรบิค (ใช้ออกซิเจน) คาร์โบไฮเดรต ถูกย่อยสลายเป็นคาร์บอนไดออกไซด์ (C02) และน้ำ เพื่อปลดปล่อยพลังงานได้อย่างมีประสิทธิภาพ ในกรณีที่เกิดการขาดออกซิเจน ร่างกายสามารถใช้การสร้างพลังงานจากคาร์โบไฮเดรตแบบ ไม่ใช้ออกซิเจนได้ ซึ่งไม่มีประสิทธิภาพ และทิ้งของเสีย และสารพิษที่เป็นกรดมากขึ้น และสามารถนำไปสู่อาการปวดของกล้ามเนื้อได้ ตัวอย่างเช่น หากกล้ามเนื้ออยู่ภายใต้ความเครียดมากเกินไป
สิ่งที่ดีมากเกินไปมั๊ย?
ปฏิกิริยาระหว่างออกซิเจน และไฮโดรเจน โดย NADH มีความเสี่ยงที่จะทำงานผิดปกติ ไม่เพียงเพราะมันเกิดขึ้นบ่อยครั้ง แต่ยังเป็นเพราะอัตราส่วนระหว่างปริมาณไฮโดรเจน และออกซิเจน (2 อะตอมของไฮโดรเจน ต่อออกซิเจน 1 อะตอม) ต้องมีตลอดเวลา ถ้าไม่มีไฮโดรเจน 2 อะตอม พร้อมใช้งาน สำหรับออกซิเจนแต่ละอะตอม จะเกิดสิ่งที่เรียกว่า สายพันธุ์ออกซิเจนปฏิกิริยา (reactive oxygen species - ROS) ขึ้น ซึ่งเกิดขึ้นประมาณ 2% ของโมเลกุลในขณะพัก ในระหว่างที่ต้องออกแรงมากโดยคนที่ไม่ได้รับการฝึกฝน หรือในช่วงที่มีการหายใจเร็ว จะเกิด ROS มากถึง 20%
อย่างไรก็ตาม ROS ยังเกิดได้จาก รังสี UV หรือไมโครเวฟ, การเผาไหม้ หรือ
ปฏิกิริยาทางเคมี เช่น จากโมเลกุลของโลหะหนัก เป็นต้น ในทางเทคโนโลยี อนุมูลของออกซิเจน เช่น ไฮโดรเจนเปอร์ออกไซด์ หรือโอโซน มีประโยชน์ในการฆ่าเชื้อโรค
อิเล็กตรอน จะอยู่เป็นคู่เสมอ อิเล็กตรอนแต่ละตัวมี "คู่" เสมอ ถ้าขาดหายไปอิเล็กตรอนที่ไม่มีคู่ จะทำปฏิกิริยากับโมเลกุลข้างเคียงเพื่อ "จัดหา" อิเล็กตรอนที่หายไป
ROS เป็นสาเหตุหลักของความเสียหายทางกายภาพ และเกี่ยวข้องกับโรคส่วนใหญ่ ROS ทำลายเซลล์ผ่านการออกซิเดชั่น, ปล้นพลังงาน โดยการขโมยอิเล็กตรอน และทำให้เซลล์อ่อนแอต่อการถูกโจมตีโดยแบคทีเรีย หรือไวรัส อนุมูลออกซิเจน ก่อให้เกิดปฏิกิริยาลูกโซ่ มันออกซิไดซ์โมเลกุลที่หนึ่ง แล้วโมเลกุลที่หนึ่งก็ไปออกซิไดซ์โมเลกุลที่สอง แล้วโมเลกุลที่สองก็ไปออกซิไดซ์โมเลกุลที่สาม ... ไปเรื่อย ๆ นอกจากนี้ ยังสามารถส่งผลให้เกิดความเสียหายต่อสารพันธุกรรม
อนุมูลอิสระและสารต้านอนุมูลอิสระ
เราต้องเผชิญหน้ากับจุลินทรีย์ต่างๆอย่างต่อเนื่อง และใช้ชีวิตร่วมกับพวกมัน โดยเฉพาะอย่างยิ่งในปาก และในลำไส้ มีแบคทีเรีย และจุลินทรีย์อื่น ๆ จำนวนมาก ที่ทำหน้าที่ดูแลการย่อย และการสลายตัวของอาหาร
เพื่อควบคุมการเจริญเติบโตของจุลินทรีย์ ระบบการป้องกันของร่างกายจึงสร้างนิวโทรฟิลซึ่งเป็นเม็ดเลือดขาวชนิดหนึ่ง เซลล์เม็ดเลือดขาว นิวโทรฟิลเหล่านี้ ผลิตอนุมูลอิสระที่สามารถออกซิไดซ์จุลินทรีย์ที่ไม่พึงปรารถนา อนุมูลอิสระ ที่เม็ดเลือดขาวสร้างขึ้นนี้เป็น "อาวุธ" ของระบบภูมิคุ้มกัน และจำเป็นต่อการอยู่รอดของมนุษย์ ต้องไม่สับสนกับ อนุมูลอิสระซึ่งเกิดจากการออกซิเดชั่นมากเกินไป, การหายใจไม่ถูกต้อง ฯลฯ ที่กล่าวข้างต้น ซึ่งทำให้ร่างกายของเราเสียหาย
ในแง่เปรียบเปรย อนุมูลอิสระที่ผลิตโดยระบบภูมิคุ้มกันของร่างกาย และใช้ในการต่อสู้กับแบคทีเรีย และไวรัส สามารถเปรียบเทียบได้กับ ตำรวจหรือกองทัพ ในขณะที่ ROS อนุมูลอิสระที่เกิดจากการออกซิเดชั่นมากเกินไป เปรียบเทียบได้กับ ผู้ก่อการร้าย ที่ต้องการสร้างความเสียหาย ร่างกาย
สารต้านอนุมูลอิสระ เป็นสารที่สามารถทำหน้าที่ "ต่อต้าน" ออกซิเดชั่นได้ ส่วนใหญ่เป็นวิตามิน แต่ยังรวมถึงสารอื่น ๆ ที่มาจากพืช เช่น OPC หรือจากสัตว์ เช่น แอสตาแซนธิน สารต้านอนุมูลอิสระมีอิเล็กตรอนจับกัน "หลวมๆ" ซึ่งสามารถไปรีดิวซ์สารออกซิไดซ์ได้ นั่นคือปล่อยอิเล็กตรอนไปยังสารออกซิไดซ์ น่าเสียดายที่สารต้านอนุมูลอิสระ ไม่สามารถแยกความแตกต่างระหว่างอนุมูลอิสระที่เป็นอันตราย และอนุมูลหลักที่มีประโยชน์ของระบบภูมิคุ้มกันได้ ดังนั้น นักวิทยาศาสตร์จึงเตือนไม่ให้บริโภคสารต่อต้านอนุมูลอิสระมากเกินไป โดยเฉพาะชนิดสังเคราะห์ อย่างไรก็ตาม วิตามินและสารต้านอนุมูลอิสระอื่น ๆ มีหน้าที่สำคัญอื่น ๆ อีกมากมายในร่างกาย นอกเหนือจากฤทธิ์ต้านอนุมูลอิสระ ดังนั้น จึงไม่ได้มีวัตถุประสงค์เพื่อเตือนการรับประทานอาหารที่อุดมไปด้วยวิตามิน และสารต้านอนุมูลอิสระจากธรรมชาติ แต่ห้ามบริโภคสารต้านอนุมูลอิสระสังเคราะห์ในปริมาณที่สูงมากเกินไป
Hydrogen (ไฮโดรเจน)
ไฮโดรเจนเป็น "พันธมิตร" ของออกซิเจนในโมเลกุลของน้ำ เช่นเดียวกับ หยินและหยางที่เป็นสิ่งที่ตรงกันข้ามกัน แต่รวมเป็นหนึ่งเดียวกัน การหลอมรวม (fusion) เป็นรูปแบบการสร้างพลังงานที่สะอาดที่สุด เกิดขึ้นในร่างกายของเรา และในเทคโนโลยีเซลล์เชื้อเพลิง
Albert Szent-Gyorgyi ผู้ได้รับรางวัลโนเบลสาขาการแพทย์ชาวฮังการี (พ.ศ. 2480) ได้ตระหนักถึงความสำคัญของไฮโดรเจนสำหรับมนุษยชาติ ในฐานะที่เป็นองค์ประกอบที่เล็กที่สุดเล็กมากจนสามารถทะลุผ่านเซลล์ทั้งหมดได้ รวมทั้ง blood- brain barrier แม้ว่าไฮโดรเจนจะไม่ใช่สารต้านอนุมูลอิสระ แต่ไฮโดรเจนสามารถรวมตัวกับ ROS ดังกล่าว เกิดเป็นน้ำ H20 จึงกำจัดอนุมูลอิสระ โดยไม่ก่อให้เกิดปฏิกิริยาลูกโซ่ของอนุมูลอิสระ
ปฏิกิริยารีดอกซ์ในธรรมชาติและเทคโนโลยี
หลังจากการเผาไหม้ ปฏิกิริยารีดอกซ์ทางเทคนิคที่รู้จักกันดีที่สุด คือ การเป็นสนิม ในขณะที่การเผาไหม้เป็นปฏิกิริยาฉับพลันของสารอินทรีย์ส่วนใหญ่ที่มีออกซิเจน การเกิดสนิม คือ
การเกิดออกซิเดชันช้าๆ อิเล็กตรอนจะถูกดึงออกจากโลหะ เพื่อให้การยึดเกาะของอะตอมเหล็กหลุดออก และเกิดการสะสมของน้ำ นอกจากการป้องกันน้ำ และกรดแล้ว สิ่งที่เรียกว่าโลหะกันกร่อน (Sacrificial Anode) เป็นสิ่งที่นิยมนำมาใช้ และมีความปลอดภัย ในการป้องกันเหล็ก หรือเหล็กกล้าจากสนิม ส่วนใหญ่วิธีนี้ถูกนำมาใช้กับเรือที่แล่นในน้ำทะเล: ชิ้นส่วนของโลหะที่ไม่ใช่เหล็ก ซึ่งมักจะเป็น สังกะสีกันกร่อน (Zinc Anodes) จะถูกขันเข้ากับตัวเรือเพื่อให้เกิดแรงดันไฟฟ้าไหลระหว่างเหล็กและสังกะสี บล็อกสังกะสีจะละลายช้าๆในน้ำ และอิเล็กตรอนไหลจากสังกะสีเข้าไปในเหล็ก เป็นผลให้ตัวเรือเหล็กมีอิเล็กตรอนอยู่ตลอดเวลาจึงไม่เกิดสนิม
ตัวอย่างปฏิกิริยารีดอกซ์ที่รุนแรงมากเกิดขึ้นกับ เทอร์ไมท์ (thermite) ซึ่งเป็นส่วนผสมของเหล็กผง และอลูมิเนียม เนื่องจากมีศักยภาพในการเกิดออกซิเดชัน รีดักชันสูงมากระหว่างโลหะทั้งสองชนิดนี้ ผงนี้สามารถติดไฟ และเผาไหม้ได้ โดยอุณหภูมิกว่า 2,000 ° C จึงใช้สำหรับเชื่อมรางรถไฟเพราะมันทำให้เหล็กเหลวเร็วมาก
ค่ารีดอกซ์ในอาหาร
สารแต่ละชนิดมีศักย์ไฟฟ้าเมื่อเทียบกับสารอื่น นั่นคือความแตกต่างของค่าไฟฟ้า ซึ่งเรียกว่า ศักยภาพในการลดออกซิเดชั่นหรือ ORP (Oxidation Reduction Potential ) ORP นี้มักจะวัดโดยสัมพันธ์กับสิ่งที่เรียกว่า อิเล็กโทรดไฮโดรเจนมาตรฐาน (standard hydrogen electrode) ซึ่งถือเป็น "ค่าศูนย์" ORP ที่วัดหน่วยเป็น mV (มิลลิโวลต์) จึงเป็นค่าความแตกต่างของประจุไฟฟ้าระหว่างสารสองชนิด ระหว่างสารนั้นๆ และอิเล็กโทรดไฮโดรเจนมาตรฐาน
การวัด ORP ในอาหารต่างๆ ให้ผลลัพธ์ดังนี้
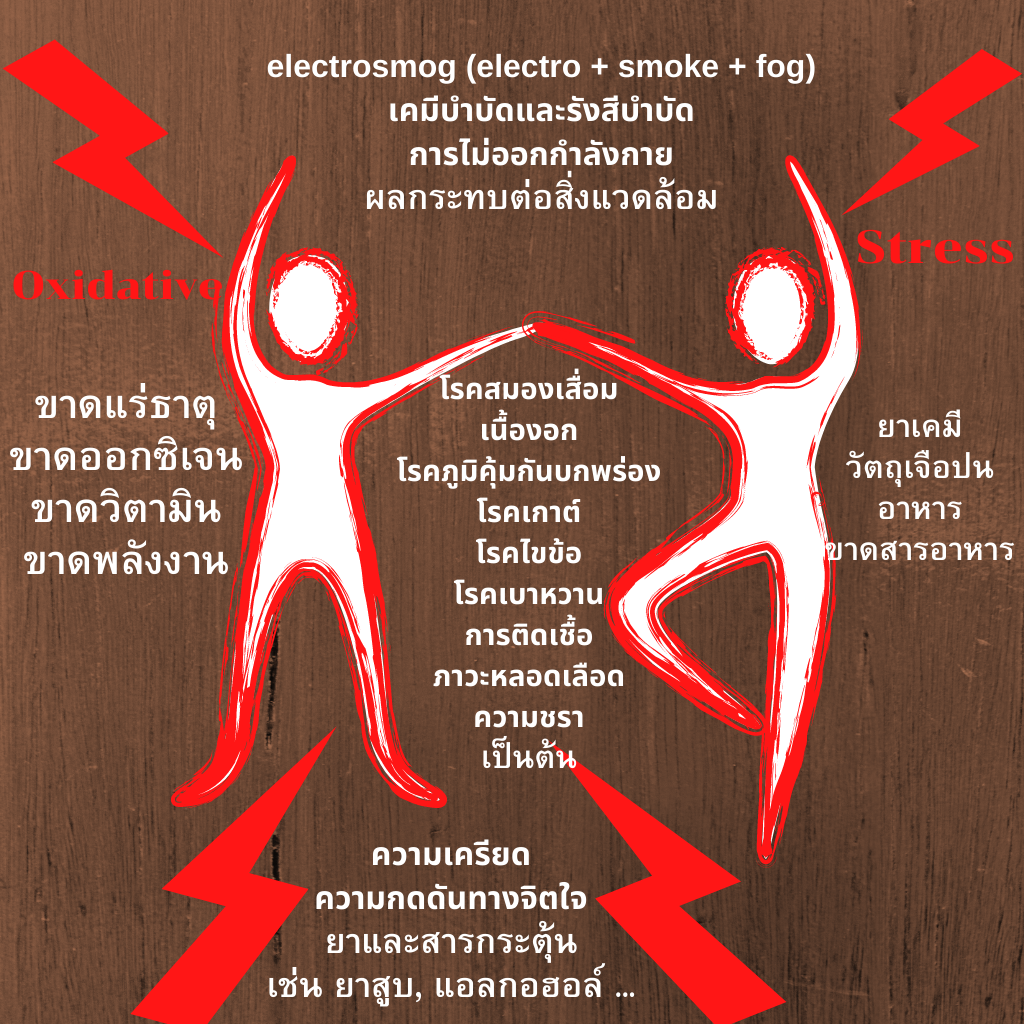
ความเครียดออกซิเดชั่น (Oxidative stress) - ตัวขโมยพลังงาน
สิ่งมีชีวิตทุกชนิดต้องการพลังงานในการดำรงชีวิต พืชได้รับพลังงานจากแสงแดดและสร้างพลังงานเคมี นี่คือรากฐานสำหรับการผลิตพลังงานไฟฟ้าชีวภาพ และช่วยดำรงชีวิตสัตว์และมนุษย์ ผลกระทบของอารยธรรมสมัยใหม่ทำให้พลังงานนั้นถูก "ขโมย" ไปจากมนุษย์และสัตว์โดยการทำลายพลังงานไฟฟ้าชีวภาพผ่านการออกซิเดชั่น: สิ่งที่เรียกว่า "ความเครียดออกซิเดชัน" จึงเกิดขึ้น
การก่อตัวและผลกระทบของอนุมูลอิสระ
คำว่า "ความเครียดออกซิเดชัน" หมายถึง ปัญหาที่มีต้นตอสาเหตุมาจากอารยธรรม และเทคนิคสมัยใหม่ ซึ่งถือเป็นสาเหตุ (ร่วม) ของโรคต่างๆที่เกิดจากวิถีชีวิตสมัยใหม่
ความเครียดนี้เกิดจากอนุมูลอิสระ ซึ่งเป็นตัวออกซิไดซ์ที่มีออกซิเจนเป็นส่วนประกอบ หรือที่เรียกว่า ROS สายพันธุ์ออกซิเจนที่ทำปฏิกิริยา (reactive oxygen species)
ความเครียดออกซิเดชั่น - สาเหตุและผลกระทบ
อนุมูลอิสระมีหลายรูปแบบ (มีเครื่องหมาย• ในสูตรเคมี):
- ไฮเปอร์ออกไซด์แอนไอออน หรือซูเปอร์ออกไซด์ (O2−) - เกิดขึ้นในกระบวนการผลิตพลังงานในไมโทคอนเดรีย และยังเกิดจากการหายใจผิด เป็นอนุมูลอิสระที่พบบ่อยที่สุดในมนุษย์ มีปฏิกิริยามาก และสามารถทำลายโครงสร้างของเซลล์ได้ ซูเปอร์ออกไซด์ถูกย่อยสลายโดยเอนไซม์ที่เรียกว่า ซูเปอร์ออกไซด์ดิสมูเทส (SOD) เป็นหลักซึ่งจะถูกเปลี่ยนเป็นไฮโดรเจนเปอร์ออกไซด์ (H2O2) ด้วยความช่วยเหลือของไฮโดรเจน - ซึ่งจะถูกย่อยสลายต่อไปเป็นน้ำ และออกซิเจน โดยเอนไซม์อื่นที่เรียกว่า catalase
- hydroxyl radical (OH•) - เป็นอนุมูลอิสระที่พบมากที่สุดในบรรยากาศ เกิดขึ้นในบรรยากาศจากโอโซน (03) และไอน้ำ ภายใต้อิทธิพลของรังสียูวี ในร่างกายอนุมูล ไฮดรอกซิล เกิดจากรังสีชนิดก่อไอออน (Ionizing radiation), โมเลกุลของโลหะหนัก และอื่น ๆ "ยิง" อิเล็กตรอนออกจากสารประกอบ OH- Perhydroxyl radical (HOO.) เกิดขึ้นในลักษณะเดียวกัน
- Peroxyl radical (ROO•) เกิดจากการออกซิเดชั่น (R คือ "สารตกค้าง" ซึ่งเป็นโมเลกุลอินทรีย์) Alkoxyl radical (RO·) เป็นผลมาจากการออกซิเดชั่นของไขมัน
โมเลกุลอื่น ๆ ที่ไม่ใช่อนุมูลอิสระโดยตรง แต่ทำหน้าที่ในทำนองเดียวกันคือ:
- ไฮโดรเจนเปอร์ออกไซด์ (H2O2) ซึ่งเป็นตัวออกซิไดซ์ที่แรงมาก ซึ่งเกิดขึ้นระหว่างการเผาผลาญโมเลกุลของน้ำตาล
- (ROOH) ไฮโดรเปอร์ออกไซด์ ซึ่งเป็นสารออกซิไดซ์ที่แรงมาก ซึ่งเกิดจากการดัดแปลงโมเลกุลอินทรีย์ เช่น ไขมันโดยการแผ่รังสีชนิดก่อไอออน, โลหะหนัก และอื่น ๆ
- (03) โอโซน เป็นก๊าซที่เกิดจากมลพิษในอากาศ และมีผลต่อการออกซิไดซ์อย่างรุนแรงต่อสิ่งมีชีวิต โอโซนจะแตกออกเป็นออกซิเจน (O2) และโมเลกุลที่เรียกว่า
- Singlet oxygen (0) ซึ่งมีความรุนแรงมาก และต้องการออกซิไดซ์โมเลกุลอื่น
ในแง่หนึ่ง อนุมูลอิสระเหล่านี้ก่อตัวภายในเซลล์ในระหว่างการเผาไหม้ หรือออกซิเดชั่น ของน้ำตาล และไขมันในไมโตคอนเดรีย ยิ่งกระบวนการเผาไหม้ / ออกซิเดชั่นดีขึ้นก็จะเกิดอนุมูลอิสระน้อยลง สำหรับการเกิดออกซิเดชั่นที่ดี และสมบูรณ์ จำเป็นต้องมีอัตราส่วนของออกซิเจน และน้ำตาลที่สมดุล และกระบวนการออกซิเดชั่นที่ไม่ถูกรบกวน ตัวอย่างเช่น ปัจจัยที่รบกวน ได้แก่ เนื้อเยื่อเกี่ยวพันที่มีกรดมากเกินไปรอบ ๆ เซลล์ ซึ่งขัดขวางการขนส่งออกซิเจนหรือสารเคมีที่ขัดขวางการเกิดออกซิเดชัน
ในทางกลับกัน อนุมูลอิสระสามารถเกิดขึ้นจากภายนอกได้เช่นกัน - โดยอิทธิพลจากภายนอก - เหนือสิ่งอื่นใด คือ กัมมันตภาพรังสี และสารออกซิไดซ์ เช่น ควันบุหรี่ และสารมลพิษอื่น ๆ
อนุมูลอิสระชอบโจมตีโปรตีน และโมเลกุลที่มีไขมันและโปรตีนในร่างกาย เนื่องจากโมเลกุลเหล่านี้มีความซับซ้อนมาก และสามารถยอมปล่อยอิเล็กตรอนได้ง่าย DNA (กรดดีออกซีไรโบนิวคลีอิก, สารพันธุกรรม) ก็เป็นเหยื่อได้ง่าย เช่นเดียวกับ proteins ในเยื่อหุ้มเซลล์ของร่างกาย, เอนไซม์ และโมเลกุลอื่น ๆ ที่มีความสำคัญต่อชีวิต ไขมัน และโปรตีนจะเปลี่ยนคุณสมบัติโดยการถูกออกซิเดชั่น และอาจมีผลทำลายร่างกาย หากได้รับความเสียหายอย่างไม่สามารถแก้ไขได้ ร่างกายจะต้องกำจัดทิ้ง หรือนำไปทิ้งใน "คลัง" ซึ่งอาจทำให้เกิดโรคต่างๆเช่น ภาวะหลอดเลือดอุดตัน
ด้วยการทำลายโปรตีนและไขมัน อนุมูลอิสระ จึงเป็นตัวกระตุ้นของความเจ็บป่วย และโรคภัยทั้งหลาย โดยเฉพาะอย่างยิ่งเมื่อร่วมกับการที่ร่างกายเป็นกรดมากเกินไป คล้ายกับสนิมที่เกิดมากขึ้นด้วยกรด โปรตีนที่ถูกกระทบจากความเครียดออกซิเดชั่น จะถูกโจมตีอย่างรวดเร็วโดยกรด และถูกทำลายและ/หรือเปลี่ยนแปลงสภาพ ดังนั้น อนุมูลอิสระจึงถือได้ว่าเป็น "สารตั้งต้น" สำหรับโรคส่วนใหญ่ที่เกิดจากวิถีชีวิตในปัจจุบัน สารต้านอนุมูลอิสระที่เพียงพอจึงเป็นข้อควรระวังที่ดีที่สุดสำหรับโรคเหล่านี้ และเป็นสิ่งที่จำเป็นสำหรับระบบภูมิคุ้มกันให้ทำงานได้ดี
อิเล็กตรอนมีความผันผวน
มนุษย์และสัตว์เลี้ยงลูกด้วยนมไม่สามารถกักเก็บอิเล็กตรอนอิสระไว้ได้ สารต้านอนุมูลอิสระ หรืออิเล็กตรอนอิสระสำหรับการต่อต้านอนุมูลอิสระ จึงต้องได้รับการผลิต หรือจัดหาอย่างต่อเนื่องเพื่อป้องกันความเครียดจากการเกิดออกซิเดชัน
พืชสามารถกักเก็บอิเล็กตรอนที่ดูดซับจากโฟตอนจากแสงแดดได้ ซึ่งแตกต่างจากมนุษย์และสัตว์เลี้ยงลูกด้วยนม พืชเก็บอิเล็กตรอนส่วนใหญ่ไว้ในผลไม้ หรือเมล็ดพืชในโมเลกุลของสารต้านอนุมูลอิสระที่อุดมด้วยอิเล็กตรอน เพื่อปกป้องเมล็ดพันธุ์ที่กำลังเติบโตจากการเกิดออกซิเดชัน อย่างไรก็ตาม ความสามารถในการกักเก็บอิเล็กตรอนนี้มีเวลา จำกัด ทันทีที่พืชตาย หรือผลไม้ หรือเมล็ดถูกเด็ด หรือหลุดออกต้น การ "สูญเสียอิเล็คตรอน" ก็เริ่มขึ้น เมื่ออิเล็กตรอนอิสระทั้งหมดถูกปล่อยออกไป แบคทีเรียที่ก่อให้เกิดการเน่าเปื่อย, เชื้อรา ฯลฯ สามารถ "โจมตี" ผลไม้ กระบวนการย่อยสลาย และเน่าเปื่อยจะเริ่มขึ้น
สิ่งนี้แสดงให้เห็นถึงความแตกต่างระหว่างสัตว์และพืช: หลังจากความตาย เนื้อสัตว์จะเริ่มย่อยสลาย และเน่าภายในไม่กี่ชั่วโมง หากไม่ผ่านกระบวนการถนอมอาหาร และไม่แช่เย็น ในขณะที่แอปเปิ้ลที่ปลูกแบบออร์แกนิก จะยังคง "กรอบ" หรืออย่างน้อยก็คงสภาพเดิม หลังจากผ่านไปหลายเดือน แม้ว่าจะไม่มีขี้ผึ้งป้องกันก็ตาม
วิธีการปลูกผักและผลไม้ มีผลต่อปริมาณสารต้านอนุมูลอิสระด้วยเช่นกัน แอปเปิ้ลที่ได้รับการปลูกด้วยปุ๋ยสารเคมี, สารกำจัดวัชพืช และยาฆ่าแมลง มีสารต้านอนุมูลอิสระน้อยกว่า หรือสูญเสียไปเร็วกว่า ดังนั้น จึงเน่าเร็วขึ้น จึงต้องได้รับการรักษาด้วยการเคลือบสารเคมีบางชนิด ในขณะที่แอปเปิ้ลที่ปลูกแบบออร์แกนิก ซึ่งแห้งและเหี่ยวเฉาเมื่อเวลาผ่านไป แต่ก็ยังกินได้ และเป็นปุ๋ยที่ดีสำหรับเมล็ดแอปเปิ้ลที่แตกหน่อ
ในอุตสาหกรรมอาหาร ค่า ORAC (ORAC = Oxygen Radial Absorbance Capacity) มีความสำคัญมากขึ้นเรื่อย ๆ มีจุดมุ่งหมายเพื่อแสดงจำนวนอิเล็กตรอนอิสระที่มีในอาหาร ซึ่งสามารถต่อต้านอนุมูลอิสระ อาหารที่ปลูกแบบออร์แกนิกมักมีค่า ORAC สูงกว่าอาหารทั่วไป
สารต้านอนุมูลอิสระและการชะลอวัย
ตัวอย่างของแอปเปิ้ลแสดงให้เห็นว่า สารต้านอนุมูลอิสระ มีอิทธิพลต่อกระบวนการชราภาพของพืช ในสัตว์เลี้ยงลูกด้วยนม สาเหตุทางชีววิทยาที่แท้จริงของกระบวนการชรายังคงเป็นที่ถกเถียงกันในทางวิทยาศาสตร์ มีหลักฐานมากมายที่บ่งชี้ว่า อายุส่วนใหญ่พิจารณาจากความสามารถของเซลล์ในร่างกายในการแบ่งตัว ตรงกันข้ามกับเซลล์ต้นกำเนิด ซึ่งสามารถแบ่งตัวไปเรื่อย ๆ "เซลล์ที่ใช้งานได้" จะแบ่งตัวประมาณ 70 ครั้ง แล้วจึงตายปรากฏการณ์นี้สามารถอธิบายได้ด้วยทฤษฎี เทโลเมียร์ ซึ่งระบุว่า ส่วนปลายของโครโมโซมในเซลล์ที่เรียกว่า เทโลเมียร์ จะสั้นลงตามการแบ่งเซลล์แต่ละครั้ง เช่นเดียวกับจิ้งจกที่หางหลุดโครโมโซมแต่ละตัวจึงสูญเสียส่วนปลายเล็ก ๆ ไประหว่างการแบ่งเซลล์ พบในภายหลังว่าอนุมูลอิสระ และความเครียดจากการออกซิเดชั่น จะเร่งให้เทโลเมียร์สั้นลง ดังนั้น หากเรา ต้องการที่จะถึงวัยที่เป็นไปได้ทางชีวภาพของเรา เราต้องตรวจสอบให้แน่ใจว่าเทโลเมียร์ไม่ได้ถูกทำลายโดยอนุมูลอิสระก่อนเวลาอันควร
สารต้านอนุมูลอิสระ และความเครียดออกซิเดชัน
ศักยภาพในการรีดอกซ์ (ORP) อธิบายถึง อิเล็กตรอนอิสระส่วนเกิน หรือขาดในร่างกายของเรา ซึ่งวัดได้ยาก เพราะแม้ว่าอิเล็กตรอนจะ "มี" ในโมเลกุลเสมอ แต่ในความเป็นจริง พวกมันมีเพียง "ความหนาแน่นของความน่าจะเป็น" เท่านั้น ซึ่งหมายความว่า (ขึ้นอยู่กับโมเลกุลที่แวดล้อมด้วย) มีอิเล็กตรอนมากหรือน้อยในช่องว่างหนึ่ง ๆ หากทำการวัดในเนื้อเยื่อของสิ่งมีชีวิต สมดุลของอิเล็กตรอนจะถูกรบกวน ทำให้เกิดการ "ขยับ" ของอิเล็กตรอน และส่งผลต่อค่าที่วัดได้
ที่ง่ายกว่า คือ การวัด ORP ในเลือด สามารถระบุได้ว่า ORP ในเลือดแดงที่สุขภาพดีมีค่าประมาณ -57 mV ในเลือดดำประมาณ -7 mV ทั้ง 2 ค่ามี ORP เป็นลบเล็กน้อย โดยมีอิเล็กตรอนส่วนเกินมากหรือน้อย ศักยภาพในการรีดอกซ์ในเนื้อเยื่อ และอวัยวะ ก็อยู่ในช่วงนี้เช่นกัน อาหารและเครื่องดื่มทุกชนิดที่มีศักยภาพในการรีดอกซ์สูง (เป็น +) จะ "ขโมย" อิเล็กตรอนจากเนื้อเยื่อ, ทำให้พลังงานในเนื้อเยื่อลดลง และทำให้ไวต่ออนุมูลอิสระ ซึ่งพบในอาหารและเครื่องดื่มแปรรูปเกือบทุกชนิด
"ฝ่ายตรงข้าม" ของอนุมูลอิสระคือ สารต้านอนุมูลอิสระ โมเลกุลที่บริจาคอิเล็กตรอนสามารถต่อต้านอนุมูลอิสระที่ขาดอิเล็กตรอน สารต้านอนุมูลอิสระที่รู้จักกันดี คือ วิตามินซี - สารต้านอนุมูลอิสระที่สำคัญอื่น ๆ ได้แก่ วิตามินอี, กลูตาไธโอน, โคเอนไซม์คิวเท็น, แมกนีเซียม, สังกะสี เป็นต้น
หน้าที่ของสารต้านอนุมูลอิสระคือ การสกัดกั้น "การโจมตี" อย่างต่อเนื่องของอนุมูลอิสระและเพื่อป้องกันความเสียหายของเซลล์ และโรคต่างๆ การทำงานของสารต้านอนุมูลอิสระสามารถได้รับการสนับสนุนโดยการจัดหาอิเล็กตรอนอิสระ เช่น จากน้ำดื่มที่อุดมด้วยอิเล็กตรอน ซึ่งจะชาร์จสารต้านอนุมูลอิสระซ้ำแล้วซ้ำเล่า เพิ่มอายุการใช้งาน และประสิทธิผลและป้องกันไม่ให้กลายเป็นตัวออกซิไดซ์เสียเอง
%MCEPASTEBIN%
Electrosmog - เป็นมากกว่าการปล้นอิเล็กตรอน
การปรากฏตัวของรังสีแม่เหล็กไฟฟ้าที่เพิ่มขึ้นอย่างถาวรและต่อเนื่องบ่อยครั้ง (การแผ่รังสีไมโครเวฟ, Electrosmog) มีผลกระทบอย่างลึกซึ้งต่อโครงสร้างอิเล็กตรอน ไม่เพียงแต่ในร่างกายของเราเท่านั้น แต่ยังรวมถึงในธรรมชาติ ในพืช และสัตว์ด้วย
การแผ่รังสีจากโทรศัพท์มือถือ, Wi-Fi และอุปกรณ์อื่น ๆ เป็นตัวขโมยอิเล็กตรอนที่แรงมากและด้วยเหตุนี้ เป็นหนึ่งในสาเหตุของอนุมูลอิสระ "ที่เกิดจากอารยธรรมสมัยใหม่" และความเครียดจากการออกซิเดชั่น ซึ่งส่งผลกระทบต่อสิ่งมีชีวิตทั้งหมด
ในร่างกายของเรา การแผ่รังสีไมโครเวฟ ทำให้เกิดผลกระทบที่ชัดเจนมาก ซึ่งจะเพิ่มขึ้นอีกจากโลหะหนัก เช่น ตะกั่ว หรือปรอท ตัวอย่างเช่น จากการอุดฟันด้วยอมัลกัม อะตอมของโลหะหนักซึ่งชอบสะสมอยู่ในอวัยวะ และในสมอง ทำหน้าที่เป็นเสาอากาศขนาดเล็ก รับและขยายสัญญาณไมโครเวฟ แต่โมเลกุลของน้ำเอง ก็เป็นเสาอากาศที่ดี ซึ่งถูกกระตุ้นด้วยคลื่นไมโครเวฟจากภายนอก
รังสีไมโครเวฟ จะเพิ่มอนุมูลอิสระในร่างกายของเราทั้งทางตรงโดยการ "ยิง" อิเล็กตรอนออกจากโมเลกุล และทางอ้อม ตัวอย่างเช่น ผลทางอ้อมของการเพิ่มขึ้นของอนุมูลอิสระในร่างกายโดยการแผ่รังสีไมโครเวฟคือ การขัดขวางการสร้างฮอร์โมนเมลาโทนินในต่อมไพเนียลซึ่งเป็นต่อมที่อยู่ใจกลางสมองของเรา เมลาโทนินไม่เพียงแต่ช่วยให้นอนหลับสบาย แต่ยังเป็นสารต้านอนุมูลอิสระที่มีประสิทธิภาพ ซึ่งเป็นตัวกำจัดอนุมูลอิสระ ดังนั้น การขาดสารนี้จะเพิ่มการก่อตัวของอนุมูลอิสระในร่างกาย นี่คือสาเหตุที่ อิเล็กโทรสโมก เป็นสาเหตุของการรบกวนการนอนหลับอย่างมาก ควรปิด Wi-Fi, โทรศัพท์ไร้สาย และโทรศัพท์มือถือ ในตอนจะนอน และสถานที่นอนควรได้รับการป้องกันรังสีจากภายนอก
การกระตุ้นโมเลกุลของน้ำโดยการแผ่รังสีไมโครเวฟ ไม่เพียงแต่เกิดขึ้นในร่างกายของเรา แต่ยังเกิดขึ้นในธรรมชาติ และโดยเฉพาะอย่างยิ่งในบรรยากาศ ซึ่งโมเลกุลของน้ำมีอยู่ทั่วไปทุกหนทุกแห่งเป็นไอน้ำและความชื้น เราสามารถต้มน้ำในเตาไมโครเวฟได้ เนื่องจากการเคลื่อนที่ของโมเลกุลของน้ำถูกกระตุ้นอย่างรุนแรง โดยการแผ่รังสีไมโครเวฟ เหมือนกับการต้มน้ำโดยใช้ความร้อน กระบวนการเดียวกันนี้เกิดขึ้นในชั้นบรรยากาศ: การแผ่รังสีไมโครเวฟที่มีอยู่ทั่วไป ทำให้โมเลกุลของน้ำทั้งหมดในอากาศสั่นด้วยความเร็วที่เพิ่มขึ้น สิ่งนี้ทำให้การก่อตัวของกลุ่มน้ำ และหยดน้ำยากขึ้น โมเลกุลของน้ำจะลอยขึ้นสู่ชั้นบรรยากาศที่สูงขึ้นเรื่อย ๆ ในช่วงไม่กี่ทศวรรษที่ผ่านมา ปริมาณไอน้ำของชั้นบรรยากาศชั้นบนเพิ่มขึ้นอย่างมีนัยสำคัญ - ในชั้นสตราโตสเฟียร์ซึ่งเป็นชั้นที่มีความอ่อนไหวเป็นพิเศษระหว่าง 15 ถึง 50 กม. เหนือระดับน้ำทะเล มีการเพิ่มขึ้นของไอน้ำในช่วง 50 ปีที่ผ่านมามากกว่า 75% ปริมาณไอน้ำถูกวัดโดยเครื่องบินพาณิชย์ที่ติดตั้งเครื่องมือวัดที่ละเอียดอ่อน ไอน้ำก็เป็น "ก๊าซภูมิอากาศ (climate gas)" ที่เป็นอันตรายเช่นเดียวกับ C02 ที่ถูกวิพากษ์วิจารณ์มาก เนื่องจากไอน้ำยังมีอิทธิพลต่อการแผ่รังสีของดวงอาทิตย์ และการแผ่รังสีความร้อนของโลก - แค่ไอน้ำไม่สามารถ "เก็บข้อมูล" ได้เหมือน C02 เท่านั้น
กรดและด่าง - ค่า pH
ความแตกต่างของกรดและด่าง เป็นกลไกการเกิดปฏิกิริยาที่สำคัญประการที่สอง ซึ่งทำให้เกิดปฏิกิริยาของสารในร่างกายของเรา ตามความหมายแล้ว กรดจะมีค่า pH ระหว่าง pH 0 (กรดมาก) - pH 6.9 ด่างจะมีค่าพีเอช ระหว่าง pH 7.1 - pH 14 (ด่างมาก) และ pH 7 เป็นกลาง
สารทั้งหมดที่สามารถ ปลดปล่อยโปรตอน เรียกว่า กรด
สารทั้งหมดที่สามารถ ดูดซับโปรตอน เรียกว่า เบส (ด่าง)
มู้ดดี้ pH
ในภาษาเยอรมัน คนที่โกรธอะไรบางอย่าง จะพูดว่า "I am acidly" แปลว่า "ฉันโกรธ" ใครที่เคยโกรธ จะรู้ดีว่าร่างกายมีปฏิกิริยาตอบสนอง: การหายใจ และชีพจรเร็วขึ้น, กล้ามเนื้อจะตึงเครียด - "อารมณ์" จะถูกถ่ายโอนไปยังร่างกาย และมีผลต่อการทำงาน และสภาพร่างกาย
| อารมณ์ของคุณ | โกรธ/รำคาญ/"เป็นกรด" | สมดุล |
| การหายใจ | เร็ว | ช้า |
| ความดันโลหิต | สูง | ปกติ |
| ชีพจร | เพิ่มขึ้น | สมดุล |
| อัตราการเต้นของหัวใจ | คงที่ | แปรผัน |
| ระบบประสาท | ไม่สงบ | สมดุล |
| กล้ามเนื้อ | ตึง | ผ่อนคลาย |
| น้ำตาลในเลือด | สูงขึ้นและผันผวน | สม่ำเสมอ |
ปฏิกิริยาของร่างกายต่ออารมณ์
การก่อตัวของกรดและด่าง
ในน้ำบริสุทธิ์ ปฏิกิริยาของโมเลกุลของน้ำ (H2O) ด้วยกัน จะแตกตัวประมาณทุกๆ
10,000,000 (107) โมเลกุล แตกตัวเป็น H+ และ OH- เรียกว่า การแตกตัวตามธรรมชาติของ
น้ำ (natural dissociation) ซึ่งมีไอออน H+ หรือ OH- อยู่ในปริมาณ 10-7 อัตราส่วนระหว่างสองโมเลกุลนี้อยู่ในภาวะสมดุล และน้ำมีพีเอชเป็นกลาง
ค่าพีเอชนี้ สามารถได้รับอิทธิพล ไม่ว่าจะโดยการเพิ่มสารที่เป็นกรดในน้ำ ซึ่งจะเพิ่มความเข้มข้นของ H+ไอออน (อาจเขียนในรูป H20H+ หรือ H30+) ซึ่งจะทำให้ pH ลดลง หรือโดยการเพิ่มสารอัลคาไลน์ลงในน้ำ ซึ่งจะลดความเข้มข้นของไอออน H+ pH จะเพิ่มขึ้น ในทางเคมีความเข้มข้นของไฮโดรเจนไอออนแสดงโดยค่า pH
ค่า pH เป็นลอการิทึมที่เป็นลบของความเข้มข้นของไฮโดรเจนไอออน :
pH = 1 /log[H+] = -log[H+]
เนื่องจากค่าความเข้มข้นถูกกำหนดโดยใช้ลอการิทึม การก้าวกระโดดจาก pH 3 เป็น pH 2 หมายถึง ความเข้มข้นของกรดเพิ่มขึ้นสิบเท่า หรือการก้าวกระโดดจาก pH 7 เป็น pH 9 ความเข้มข้นของด่างเพิ่มขึ้นร้อยเท่า
กรด มีความเข้มข้นของไอออน H+ สูง (ไอออนของไฮโดรเจน ซึ่งขาดอิเล็กตรอนหนึ่งตัว) บ่อยครั้ง (แต่ไม่เสมอไป) กรดจึงเป็นสารออกซิไดซ์
ในทางกลับกัน เบส (ด่าง) มีไอออนของ OH- (ไฮดรอกซิลไอออน) ในสัดส่วนที่สูง ซึ่งมีอิเล็กตรอนส่วนเกินอย่างน้อยหนึ่งตัว บ่อยครั้ง (แต่ไม่เสมอไป) ด่างจึงเป็นสารรีดิวซ์
ค่า pH โดยประมาณสามารถวัดได้ง่ายมากโดยใช้อินดิเคเตอร์ ซึ่งเป็นสารเคมีที่เปลี่ยนสีตามการเปลี่ยนแปลงของ pH ได้แก่ กระดาษลิตมัส (กรด: แดง, อัลคาไลน์: ม่วง) และไทมอลบลู (กรดมาก: แดง, เป็นกรดถึงเป็นกลาง: เหลือง, อัลคาไลน์: น้ำเงิน) เครื่องมือวัดแบบอิเล็กทรอนิกส์มีความแม่นยำกว่า
ความเปรี้ยว ไม่ได้เป็นกรดเสมอไป
สารใดๆจะเป็นกรด หรือด่างในร่างกายนั้น ค่อนข้างไม่ขึ้นกับรสชาติ เครื่องดื่มที่มีรสเปรี้ยวมาก เช่น น้ำมะนาว ประกอบด้วยกรดอินทรีย์เป็นส่วนใหญ่ซึ่งจะเปลี่ยนเป็นคาร์บอนไดออกไซด์โดยการเผาไหม้ในเซลล์ของร่างกาย และขับออกทางปอด วิธีการกำจัดกรดนี้ยังคงใช้ได้ดีในคนส่วนใหญ่ ร่างกายมนุษย์ได้รับการออกแบบมาเพื่อกำจัดคาร์บอนไดออกไซด์จำนวนมาก ดังนั้น กรดอินทรีย์ส่วนใหญ่จึงไม่ก่อให้เกิดปัญหา
ผลของสารในร่างกาย ส่วนใหญ่ขึ้นอยู่กับองค์ประกอบที่ไม่ถูกเผาผลาญทำให้กลายเป็นคาร์บอนไดออกไซด์ และขับออกทางปอด หรือปล่อยออกจากร่างกายในรูปก๊าซ สารเหล่านี้ส่วนใหญ่เป็นแร่ธาตุที่เหลือเป็นเถ้าถ่านเมื่ออาหารถูกเผาผลาญ
ดังนั้น ผัก และผลไม้จึงมีแร่ธาตุอัลคาไลน์ในปริมาณมาก และมีฤทธิ์เป็นด่างต่อร่างกาย เนื้อสัตว์ มีแร่ธาตุที่เป็นกรดในปริมาณมาก จึงมีฤทธิ์เป็นกรด
ปัญหาคือ สารที่เป็นกรดที่มนุษย์สร้างขึ้น ซึ่งไม่ได้เกิดขึ้นในธรรมชาติ สารเหล่านี้ เช่น กรดออร์โธฟอสฟอริก ซึ่งเป็นกรดฟอสฟอริกเทียมที่มีอยู่ในน้ำอัดลม ร่างกายยังไม่ได้พัฒนากลไกการขับออก ดังนั้น จึงเป็นเรื่องยากที่ร่างกายจะขับสารเหล่านี้ออกมาได้ ร่างกายทำให้สารเหล่านี้เข้มข้น และทำให้เป็นกลางโดยกระบวนการของร่างกาย หลังจากนั้นทำให้แข็งขึ้นและสะสมไว้ในร่างกาย เช่นเดียวกันกับสารสังเคราะห์อื่น ๆ ซึ่งใช้เป็นสารเติมแต่งทางโภชนาการให้กับวัตถุดิบอาหารที่ผลิตในอุตสาหกรรม, สารซึ่งละลายจากภาชนะพลาสติก เช่นขวด PET หรือภาชนะเคลือบ เช่น กระทะเทฟลอน หรือดูดซึมโดยอาหาร หรือน้ำที่ปนเปื้อน: สารเหล่านี้ ร่างกายจะขับออกยากมาก
Hyperacidity โรคที่เกิดจากวิถีชีวิต
ความสมดุลของกรดเบสเป็นตัวกำหนดพื้นฐานทางเคมีของร่างกายมนุษย์ ควบคุมการหายใจ, การไหลเวียน, การย่อยอาหาร, การขับถ่าย, ระบบภูมิคุ้มกัน, สมดุลของฮอร์โมน และอื่น ๆ
ร่างกายของเราประกอบด้วยเซลล์ประมาณหนึ่งแสนล้านเซลล์ ในแต่ละเซลล์เหล่านี้ ไมโทคอนเดรีย จำนวนหลายร้อย จะผลิตพลังงาน, คาร์บอนไดออกไซด์ (CO2), น้ำ และสารตกค้างจากการเผาผลาญที่เป็นกรดอย่างต่อเนื่อง คาร์บอนไดออกไซด์ ละลายน้ำเป็น กรดคาร์บอนิก และถูกขนส่งไปยังปอดและถูกขับออกมา การเผาผลาญของเซลล์จะสร้าง กรดยูริกออกมาอย่างต่อเนื่อง ซึ่งไตสามารถขับออกได้ ดังนั้น กระบวนการผลิตพลังงานทั้งหมดในสิ่งมีชีวิตจึงเกิดกรด
กรดอื่น ๆ เกิดจากแร่ธาตุที่เป็นกรดในอาหาร ขึ้นอยู่กับแร่ธาตุที่มีอยู่ในอาหาร กรดจะเกิดขึ้น เช่น กรดฟอสฟอริก และกรดซัลฟิวริกจากเนื้อสัตว์ กรดฟอสฟอริก จากกรดออร์โธฟอสฟอริกจากเครื่องดื่มโคล่า ซึ่งย่อยสลายยากมาก และอื่น ๆ นอกจากนี้ กรดอื่น ๆ ยังเกิดขึ้นในลำไส้อันเป็นผลมาจากกระบวนการเน่าเปื่อย: ไฮโดรเจน ซัลไฟด์, แอมโมเนีย, ฮิสตามีน, อินโดล, ฟีนอล และสกาโตล ถือได้ว่าเป็นสาเหตุของโรคผิวหนัง, อาการแพ้ และความเสียหายของตับ อินโดลจัดเป็นสารก่อมะเร็งด้วยซ้ำ
Hyperacidity เกิดในน้ำเหลือง
เนื่องจากการออกซิเดชั่น (การเผาไหม้) ทำให้เกิดกรดในเซลล์เสมอ (แม้จะรับประทานอาหารที่เป็นด่างก็ตาม กระบวนการเผาผลาญจะผลิตกรดมากกว่าด่าง) ร่างกายจึงขับกรดออกมาเสมอ กรดจะถูกลำเลียงออกจากเซลล์ผ่านทางน้ำเหลืองและถูกขับออกมา:
คาร์บอนไดออกไซด์ C02 และกรดแก๊สอื่น ๆ จะถูกขับออกทางเลือดและการหายใจ กรดยูริก และกรดเหลวอื่น ๆ เป็นปัสสาวะทางไต และกรดอื่น ๆ เป็นเหงื่อทางผิวหนัง หากความสามารถในการขับของเสียหมดลง ค่า pH ของน้ำเหลืองจะลดลงอย่างช้าๆ
ถ้าน้ำเหลืองมีพีเอชกลายเป็นกรด โครงสร้างโปรตีนในน้ำเหลืองจะเริ่มแข็งตัว และกลายเป็นเหมือนเจล มีความหนืดและเฉื่อย ทำให้ไม่สามารถทำหน้าที่เป็นระบบขนส่งได้อย่างเพียงพออีกต่อไป การได้รับสารอาหาร และการกำจัดของเสียของเซลล์บกพร่อง:
ในแง่หนึ่งเซลล์จะไม่ได้รับออกซิเจนและสารอาหารที่เพียงพออีกต่อไป ในทางกลับกันกรดตกค้าง (ของเสีย) ไม่สามารถกำจัดออกจากกระบวนการเผาไหม้ที่เกิดขึ้นในเซลล์ได้อีกต่อไป ผลที่ตามมาตัวอย่างเช่น ความดันโลหิตสูง เกิดขึ้นเมื่อร่างกายตอบสนองต่อการขาดออกซิเจนในเซลล์ที่เกิดจากประสิทธิภาพการขนส่งที่ไม่ดีของน้ำเหลืองที่มีพีเอชเป็นกรดเกิน การควบคุมร่างกายของเราจะเพิ่มความดันโลหิตเพื่อที่จะผลักดันออกซิเจนเข้าไปในน้ำเหลืองมากขึ้น เพื่อเพิ่มปริมาณออกซิเจนของเซลล์ร่างกาย
การพัฒนาของโรคเบาหวาน ก็สามารถเข้าใจได้ด้วยวิธีนี้: ร่างกายจะตอบสนองด้วยการเพิ่มระดับน้ำตาลในเลือด เนื่องจากการขาดน้ำตาลในเซลล์ ซึ่งเกิดขึ้นเมื่อน้ำตาลถูกป้องกันไม่ให้ไปถึงเซลล์โดยน้ำเหลืองที่มีพีเอชกรดมากเกินไป
ค่า pH โดยประมาณของน้ำเหลือง สามารถดูได้ด้วยค่า pH ของน้ำลาย ค่า pH ของน้ำลาย ควรวัดอย่างน้อยสองชั่วโมงโดยไม่รับประทานอาหารและดื่ม ซึ่งควรจะเป็นด่างเล็กน้อยประมาณ pH 7.2 ผู้เชี่ยวชาญหลายคนระบุว่า ค่า pH ของน้ำลายที่เป็นกรดเป็นเรื่องปกติอย่างไรก็ตามนี่แสดงให้เห็นว่า คนส่วนใหญ่ ร่างกายมีความเป็นกรดมากเกินไปเท่านั้น ไม่ใช่ว่าค่า pH ของน้ำลายที่เป็นกรดจะดี ฟันที่มีสุขภาพดี จะอยู่ได้เป็นเวลานานในสภาพแวดล้อมที่น้ำลายเป็นด่างเล็กน้อย ค่า pH ของน้ำลายบอกได้มากเกี่ยวกับความสมดุลของกรดเบสและจะมีการเปลี่ยนแปลงค่าพีเอชอย่างช้าๆเท่านั้น หาก pH ของน้ำลายต่ำกว่า pH 6 แสดงว่าร่างกายมีกรดเกินเรื้อรัง ในโรคร้ายแรงเช่นมะเร็งเราพบค่า pH ของน้ำลายที่ต่ำกว่า pH 6
เพื่อบรรเทาภาวะ hyperacidity ของน้ำเหลือง และเพื่อป้องกันภาวะ hyperacidity ที่เป็นอันตรายถึงชีวิตของเนื้อเยื่อเกี่ยวพัน ร่างกายจะใช้กลอุบาย:
โดยรวบรวมกรดส่วนเกินให้เข้มข้นขึ้น และรวมตัวกับแร่ธาตุอัลคาไลน์ เช่น แคลเซียมจากกระดูก และสะสมกรดเกลือเหล่านี้ไว้ ตัวอย่างเช่น แคลเซียมซัลเฟต (เกลือจากแคลเซียมและกรดซัลฟิวริก) กรดเกลือเหล่านี้ก่อตัวเป็นตะกรันที่เป็นกรด เป็นนิ่วในไต, คราบตะกรันที่ข้อต่อและในเนื้อเยื่อเกี่ยวพัน, คราบสกปรกในเส้นเลือด หรืออาจจะแค่รวมตัวอยู่ในจุดเดียวกันในความเข้มข้นสูงในรูปของเหลวในเนื้อเยื่อเกี่ยวพัน
การที่ของเสียที่เป็นกรดรวมตัวกันอยู่ที่จุดๆหนึ่งด้วยความเข้มข้นสูง ทำให้เกิดการแข็งตัวของเลือดเฉพาะที่ ดังนั้น โดยเฉพาะในเส้นเลือดฝอย และอวัยวะส่วนปลายจะได้รับเลือดน้อยลง พบว่า มักจะมีการสะสมกรดของเสียเป็นเนื้อเยื่อไขมัน (fatty acids - กรดไขมัน) ในส่วนผิวหนังชั้นไขมัน และระหว่างอวัยวะ จึงทำให้การไหลเวียนของเลือดไปยังอวัยวะข้างเคียงไม่เพียงพอ
การที่กรดของเสียจะสะสมอยู่ที่ส่วนใดของร่างกาย และการที่ร่างกายจะกำจัดกรดของเสียออกด้วยลำดับขั้นตอนอย่างไรนั้น ดูเหมือนจะขึ้นอยู่กับความบกพร่องทางพันธุกรรมและเป็นกรรมพันธุ์
ตัวอย่างเช่น ในครอบครัวที่มีความเสี่ยงต่อโรคเบาหวาน กรดส่วนเกินส่วนใหญ่จะสะสมอยู่ในช่องท้องถัดจากตับอ่อน ในรูปของเกลือของกรด หรือสารละลายเกลือของกรด ซึ่งจะขัดขวางการไหลเวียนของเลือด และการได้รับสารอาหารของตับอ่อน และนำไปสู่ความผิดปกติที่เกิดขึ้นตามที่ทราบกันดี
ในครอบครัวที่มีความเสี่ยงต่อการเป็นโรคหัวใจวาย หรือโรคหลอดเลือดสมอง กรดส่วนใหญ่จะเกิดขึ้นในหลอดเลือดแดง ในครอบครัวที่มีโรครูมาติก เช่น โรคเกาต์, โรคข้ออักเสบ ฯลฯ กรดส่วนใหญ่จะสะสมในข้อต่อ นอกจากนี้ ในผู้ที่มีปัญหาผมร่วงจากกรรมพันธุ์ เกิดเพียงเพราะว่า ร่างกายของบุคคลในตระกูลนี้ ด้วยเหตุผลทางพันธุกรรม ใช้คลังแร่ธาตุจากรากผมในการรวมตัวกับกรดของเสีย ก่อนที่จะหันไปใช้แร่ธาตุจากแหล่งอื่น
เมื่อต้องรับมือกับกรดส่วนเกิน มีคนอยู่ 2 ประเภท คือ
- ประเภทแรก ร่างกายสามารถรวบรวมกรดให้เข้มข้นและเก็บสะสมในร่างกายได้เร็วมาก คนพวกนี้จะยังมีรูปร่างเป็นปกติ ไม่อ้วน และไม่รู้สึกว่าร่างกายมีอะไรผิดปกติ ไม่สนใจอาการปวดเมื่อย "ทั่วไป" และความเจ็บป่วยเล็กๆน้อยๆของร่างกาย จนกระทั่งเกิด "อุบัติเหตุ" อย่างรุนแรง เช่น โรคหลอดเลือดสมอง หรือหัวใจวายในทันที เราอาจพบผู้จัดการวัย 50 ปีที่ดูมีสุขภาพดี ที่จู่ๆก็เสียชีวิตลงหลังจากอาการเส้นเลือดในสมองแตก หรือหัวใจวายระหว่างการวิ่งในป่าเป็นตัวอย่างที่น่าเศร้า แต่ก็ไม่ใช่เรื่องแปลก สำหรับคนพวกนี้ การสลายตัวของกรดที่สะสมไว้ อาจใช้เวลาค่อนข้างนาน
- คนอีกประเภทหนึ่ง ร่างกายจะเจือจางกรดส่วนเกินด้วยน้ำ และเก็บสะสมไว้อย่างช้าๆ ส่งผลให้น้ำหนักตัวเพิ่มขึ้น ไม่สบายตัว และรู้สึกไม่สบาย โดยปกติแล้วคนเหล่านี้เต็มใจที่จะทำอะไรบางอย่างเพื่อสุขภาพของตนเองมากกว่าประเภทแรก น้ำหนักเกินของพวกเขาไม่เพียง แต่เป็นไขมันเท่านั้น แต่ยังเป็นน้ำที่ถูกกักเก็บไว้ด้วย การเปลี่ยนแปลงพฤติกรรมการบริโภคอาหาร ให้เป็นการรับประทานอาหารที่ไม่มีน้ำตาล, อาหารด่างอย่างสม่ำเสมอ สามารถให้ผลลัพธ์ในเชิงบวก
เมื่อพูดถึง "ภาวะ hyperacidity" เรามักจะพูดถึงภาวะที่น้ำเหลืองและเนื้อเยื่อเกี่ยวพัน เป็นกรดมากเกินไปหรือเกินปกติ ไม่ได้หมายถึงพีเอชของอวัยวะ, สมอง หรือเลือด
เอนไซม์และ hyperacidity
เอนไซม์เป็นสิ่งที่มีบทบาทมากที่สุดในร่างกายของเรา วิทยาศาสตร์ในปัจจุบัน รู้จักเอนไซม์ที่แตกต่างกันมากกว่า 1,000 ชนิด แต่ยังไม่ได้รับการวิจัยทั้งหมด และกำหนดโหมดการทำงานของมัน เอนไซม์ ทำหน้าที่เปิดใช้งาน และเร่งปฏิกิริยาทางชีวเคมี หากไม่มีเอนไซม์ร่างกายของเราจะไม่สามารถ "ทำหน้าที่" ได้ พวกมันมีบทบาทสำคัญในการเผาผลาญ ทั้งในมนุษย์และพืช เนื่องจากเอนไซม์ทำหน้าที่เปิดใช้งาน และควบคุมทั้งวงจรซิเตรตซึ่งสัตว์เลี้ยงลูกด้วยนมใช้ "ผลิต" พลังงาน และการสังเคราะห์แสงของพืช ระบบประสาท, การดูดซึมสิ่งเร้าภายนอก และการส่งผ่านไปยังสมอง ทำงานผ่านเอนไซม์เท่านั้น เอนไซม์ยังมีส่วนร่วมในการควบคุมระบบภูมิคุ้มกัน
เอนไซม์ - มักจะมีชื่อลงท้ายด้วย "-ase" - ประกอบด้วยโปรตีนหลายชนิด และมักมี "อะตอมหลัก" เป็นโลหะหรือแร่ธาตุ เช่น เหล็ก, สังกะสี, ทองแดง, ซีลีเนียม, เจอร์เมเนียม เป็นต้น ดังนั้น แร่ธาตุต่างๆ จำเป็นต่อการสร้างเอนไซม์บางชนิด เนื่องจากร่างกายจะสร้างเอนไซม์เมื่อจำเป็นจะต้องใช้ และถูกทำลายทิ้งเมื่อหมดความจำเป็น ดังนั้น ส่วนประกอบที่ใช้ผลิตเอนไซม์จึงต้องมี "อยู่ในสต็อก" ตลอด อย่างไรก็ตาม เกลือแร่ โดยเฉพาะเช่น สังกะสี, เจอร์เมเนียม, โมลิบดีนัม, ซีลีเนียม และอื่น ๆ แทบจะไม่มีอยู่ในอาหารสมัยใหม่อีกต่อไป ซึ่งอาจทำให้เกิดปัญหา เนื่องจากร่างกายต้องการแร่ธาตุเหล่านี้ เพื่อการทำงานของเอนไซม์อย่างเหมาะสม
ที่น่าสนใจคือ การขาดแร่ธาตุนี้ พบมากในอาหารสัตว์ อาหารม้าที่ดี จะมีแร่ธาตุต่างๆมากถึง 20 ชนิด อาหารไก่มีอย่างน้อย 5 ชนิด ในขณะที่ยังคงแนะนำว่า "อาหารที่สมดุล" ตาม "ปิรามิดอาหาร" จะช่วยให้มนุษย์ได้รับอาหารที่ครบถ้วน และครอบคลุมสารทั้งหมดที่จำเป็นสำหรับชีวิต
ในดินที่มีสุขภาพดี ควรมีธาตุต่าง ๆ หลากหลายชนิด - ถึงแม้ว่าจะอยู่ในปริมาณน้อยก็ตาม - เพื่อให้พืชสามารถดูดซึมได้ - ในปริมาณน้อยอีกเช่นเดียวกัน - และเพื่อให้มนุษย์ได้รับ เมื่อกินพืชเหล่านั้น เนื่องจากฝนกรดในศตวรรษที่ผ่านมาได้ชะล้างแร่ธาตุอัลคาไลน์ออกจากชั้นบนของพื้นผิวโลก และการใช้ NPK "ปุ๋ยผสม" (ไนโตรเจน, ฟอสฟอรัส, โพแทสเซียม) อย่างกว้างขวาง จึงได้แทนที่แร่ธาตุอื่น ๆ ในดิน แร่ธาตุที่จำเป็นแทบจะไม่พบในดิน ทำให้ไม่เหมาะแก่การเพาะปลูกพืชอีกต่อไป ดังนั้น แร่ธาตุที่มีประโยชน์จึงไม่สามารถถูกดูดซึมได้โดยพืช การขาดองค์ประกอบแร่ธาตุเหล่านี้ นำไปสู่การขาดเอนไซม์ที่จำเป็น ซึ่งมักวินิจฉัยไม่ได้ และส่งผลให้ปฏิกิริยาต่างๆของร่างกายขาดตกบกพร่อง, ช้า หรือผิดพลาด
เนื่องจากเอนไซม์ประกอบด้วยโปรตีนเป็นหลัก จึงมีความไวต่อกรด ในสภาพแวดล้อมที่เป็นกรด กิจกรรมของเอนไซม์จะลดลง และถูกขัดขวาง หรือไม่สามารถก่อตัวได้เลย ดังนั้นภาวะ hyperacidity จึงเป็นอีกสาเหตุหนึ่งของการขาดเอนไซม์
ตัวอย่างเช่น ผู้ที่เป็นโรคภูมิแพ้ จะรู้สึกถึงผลของเอนไซม์ที่ขาดหายไป:
ฮอร์โมนฮิสตามีนจะถูกปล่อยออกมาเมื่อมีสิ่งแปลกปลอมเข้าสู่ร่างกายหรือเกิดการบาดเจ็บ มีบทบาทสำคัญในการป้องกันสารแปลกปลอมเหล่านี้ และทำให้เกิดอาการคัน, ปวด และกล้ามเนื้อหดตัว เมื่อฮีสตามีนทำงานได้แล้วจะถูก "ทำลาย" และถูกเอนไซม์หลายตัวย่อยสลาย เอนไซม์เหล่านี้ต้องการโมลิบดีนัมและทองแดง หากขาดโมลิบดีนัมและทองแดง จะไม่สามารถสร้างเอนไซม์ได้ และการย่อยสลายฮีสตามีนจะไม่เกิดขึ้น ฮีสตามีนยังคงทำงานต่อไปโดยไม่มีข้อจำกัด - ด้วยผลที่ไม่พึงประสงค์จากอาการแพ้
นอกจากนี้แล้ว เอนไซม์ยังเป็น "เครื่องมือ" ของร่างกาย ยกตัวอย่างเช่น แมคโครฟาจ ("big eaters") เป็น "ทหาร" ของระบบภูมิคุ้มกัน โดยจับกินแบคทีเรีย,ไวรัส และเชื้อรา ซึ่งเป็นสิ่งแปลกปลอม รวมถึงเซลล์ที่ตายแล้ว และเศษเซลล์และ "ของเสีย" อื่น ๆ ในเนื้อเยื่อเกี่ยวพันด้วย แมคโครฟาจทำงานโดยอาศัยความช่วยเหลือของเอนไซม์ที่จะสลายสารที่กินเข้าไปให้เป็นส่วนประกอบต่างๆ เพื่อให้สามารถถูกขับออก หรือนำกลับมาใช้ใหม่ได้ แมคโครฟาจจะอ่อนแอลงเมื่อสภาพแวดล้อมเป็นกรด ซึ่งจะขัดขวางระบบภูมิคุ้มกันในการตอบสนองอย่างเหมาะสม
ออกซิเจน และคาร์บอนไดออกไซด์ในกระบวนการหายใจ
ออกซิเจนมีประโยชน์ เราเชื่อมโยงออกซิเจนกับชีวิต, ความสดชื่น และสุขภาพ เป็นความจริงที่ว่า ออกซิเจนมีความสำคัญ และร่างกายของเราได้ปรับให้เข้ากับปริมาณออกซิเจน 21% ของอากาศแล้ว อย่างไรก็ตาม ก็เป็นความจริงเช่นกันว่า ออกซิเจนเป็นตัวออกซิไดซ์ที่ร้ายแรงและออกซิไดซ์สารหลายชนิด ทำให้ไหม้, เป็นสนิม หรือเหม็นหืน
ในปอด ออกซิเจน (O2) จะถูกดูดซึมเข้าสู่เลือด เพื่อที่จะขนส่งโดยเซลล์เม็ดเลือดแดง (erythrocytes) เข้าไปในเส้นเลือดฝอย และจากที่นั่น จะแพร่กระจายไปยังเนื้อเยื่อเกี่ยวพัน และไปยังเซลล์ เม็ดเลือดแดงไม่ใช้ออกซิเจน พวกมันสร้างพลังงานที่จำเป็นสำหรับการเผาผลาญโดยกระบวนการหมักโดยไม่ใช้ออกซิเจน
หลังจากปล่อยออกซิเจนในเส้นเลือดฝอย เม็ดเลือดแดงจะดูดซับคาร์บอนไดออกไซด์ (CO2) เพื่อนำไปยังปอดเพื่อหายใจออก ทั้ง O2 และ CO2 จะถูกเก็บไว้ในฮีโมโกลบิน ซึ่งเป็นเม็ดสีของเม็ดเลือดแดง อย่างไรก็ตาม ปฏิกิริยาของฮีโมโกลบินขึ้นอยู่กับค่า pH ของสภาพแวดล้อม: ยิ่งมีความเป็นด่างมากเท่าไหร่ ออกซิเจนก็จะถูกดูดซึมได้ดีขึ้น และหากสภาพแวดล้อมยิ่งมีความเป็นกรดมากขึ้น ออกซิเจนก็จะยิ่งถูกดูดซึมได้แย่ลง
ดังนั้น ฮีโมโกลบินจึงต้องการค่า pH ที่ประมาณ pH 7.3 เพื่อให้สามารถดูดซึม และปลดปล่อยออกซิเจนในอัตราส่วนที่สมดุล Bohr Effect (ตั้งชื่อตามนักฟิสิกส์ชาวเดนมาร์ก Christian Bohr บิดาของนักฟิสิกส์ Nils Bohr) มีผลกระทบอย่างมาก หากค่า pH ในเลือดสูงขึ้นจากปฏิกิริยาที่ตอบสนองต่อความเป็นกรดเกินของเนื้อเยื่อเกี่ยวพัน: ค่าความอิ่มตัวของออกซิเจนในเลือดอาจเป็นที่น่าพอใจหรือดีเยี่ยม แต่เซลล์ในร่างกายของเรายังไม่ได้รับออกซิเจน เนื่องจากฮีโมโกลบินในเลือดดูดซับออกซิเจนได้ดี แต่มีปัญหาในการปลดปล่อยออกซิเจนออกมา ยิ่งค่า pH ในเลือดสูงขึ้น 02 ก็จะเข้าสู่เซลล์น้อยลง
ผลลัพธ์อีกประการหนึ่งของ Bohr Effect คือ ฮีโมโกลบินที่บรรจุ 02 สามารถดูดซับ C02 ได้น้อยลง เนื่องจากการขนส่ง CO2 จากเนื้อเยื่อเกี่ยวพันถูกขัดขวาง และความเข้มข้นของ CO2 ในเลือดก็ลดลงเช่นกัน ปริมาณ C02 ที่ลดลงในเลือด จะช่วยเร่งการเพิ่มขึ้นของค่า pH เนื่องจาก C02 ที่ละลายในของเหลว จะทำให้ของเหลวนั้นเป็นกรด และจะทำให้ค่า pH ลดลง
ครั้งต่อไปที่คุณวัดความดัน และออกซิเจนในเลือด ให้ถามแพทย์ว่า ทราบถึงความสัมพันธ์ทางสรีรวิทยาเหล่านี้หรือไม่ เนื่องจากการวัดออกซิเจนในเลือดโดยไม่ทราบค่า pH ในเลือดนั้นค่อนข้างไร้ความหมาย
ด้วยการฝึกการหายใจแบบเฉพาะเจาะจง ซึ่งจะช่วยลดปริมาณออกซิเจน และเพิ่มปริมาณก๊าซคาร์บอนไดออกไซด์ในเลือด ค่า pH ของเลือดจะลดลงอีกครั้ง ในระดับที่ไม่เพียงแต่ดูดซับออกซิเจนได้ดีเท่านั้น แต่ยังปล่อยออกซิเจนออกมาได้ดีอีกด้วย การฝึกการหายใจที่มีผลดังกล่าวนี้ เป็นที่รู้จักกันดีในวัฒนธรรมทางตะวันออก เช่น ไทจิ (Tai-Chi) ของจีน, พระเวทของอินเดีย เป็นต้น ทางวิทยาศาสตร์ได้รับการพัฒนาโดยแพทย์ชาวรัสเซีย คอนสแตนติน บูเตย์โก (Konstantin Buteyko)
ปัจจุบันนี้ การฝึกหายใจแบบ Frolov (Frolov breathing training ) เป็นรูปแบบที่ทันสมัยที่สุดของการฝึกประเภทนี้ โดยมีผลดีอย่างมาก ไม่เพียงแต่ในโรคทางเดินหายใจเท่านั้น แต่ยังรวมถึงประสิทธิภาพและสุขภาพโดยทั่วไปด้วย การฝึกนี้มีพื้นฐานมาจากการสังเกตว่าการหายใจตามปกติของคนส่วนใหญ่ในโลกสมัยใหม่ เป็นการหายใจที่เร็วเกินไป ซึ่งเกี่ยวข้องกับความเครียด ก่อนอื่นเราต้องเรียนรู้การหายใจด้วยกระบังลม เพราะคนส่วนใหญ่หายใจด้วยหน้าอกเท่านั้น จากนั้นฝึกปฏิบัติที่จะค่อยๆยืดเวลาหายใจออกโดยต้านแรงทีละ 1 วินาทีต่อสัปดาห์ ฝึก 20 ถึง 30 นาทีทุกวัน จนกว่าจะถึงเวลาหายใจออก 30 วินาทีและนานกว่านั้น
สัญญาณของ hyperacidity - บ่อเกิดของโรค
ในงานวิจัยจำนวนมาก แพทย์ด้านธรรมชาติบำบัดชี้ให้เห็นว่า ภาวะ hyperacidity ของน้ำเหลือง และเนื้อเยื่อเกี่ยวพัน กลายเป็นภาวะที่พบได้แพร่หลาย เพราะคนจำนวนมากมีการขับกรดที่เกิดจากการย่อยอาหาร และการเผาผลาญของเซลล์ ออกทางปอด, ไต และผิวหนัง มากเกินไป
ในภาษาเยอรมัน มีคำพูดว่า "ฉันเป็นกรด" แปลว่า "ฉันโกรธ" - แสดงให้เห็นว่า ร่างกายและจิตใจของมนุษย์มีความสัมพันธ์กัน
ภาวะ hyperacidity นี้ มักเกิดขึ้นก่อนในด้านจิตใจ และมีผลต่อพฤติกรรม คนที่ "เป็นกรด" จะหงุดหงิดง่าย, ไม่พอใจ, ใจร้อน, ก้าวร้าว และไม่เป็นมิตร ความไม่พอใจและความก้าวร้าวทำให้เกิดความเครียด ซึ่งเป็น "ตัวสร้างกรด" ที่รุนแรง ความเครียดทางจิตใจสามารถวัดได้ในเลือด ซึ่งก็คือ การมีระดับของอนุมูลอิสระเพิ่มมากขึ้น และนี่คือจุดเริ่มต้นของโรค
โชคร้ายที่ความเครียดทางจิตใจกลายเป็นความเครียดทางร่างกายอย่างรวดเร็ว ซึ่งมักเกิดจากการนอนหลับที่ไม่ดี ทำให้เกิดความเหนื่อยล้า ตามด้วยปฏิกิริยาชดเชย อื่น ๆ เช่น การบริโภคแอลกอฮอล์, การสูบบุหรี่ หรือการรับประทานอาหารมากเกินไป และนี่คือระดับที่สองของบ่อเกิดโรค ภาวะเหล่านี้ มักถือเป็น "ความบกพร่องตามปกติที่เกิดขึ้นได้" ซึ่งไม่ช้าก็เร็ว จะพัฒนาไปสู่ความเจ็บป่วยที่รุนแรงขึ้น ซึ่งต้องได้รับการรักษา อย่างไรก็ตาม เนื่องจากการรักษามักไม่ได้เริ่มต้นที่สาเหตุ ซึ่งก็คือความเป็นกรดสูงเกิน แต่มักเป็นการรักษาตามอาการเท่านั้น และพยายามที่จะบรรเทาอาการเหล่านี้ด้วยยาที่มักจะสร้างกรดอีกครั้ง จึงทำให้นำโรคไปสู่ระดับถัดไปอย่างรวดเร็ว
โรคต่อไปนี้อาจเกิดจากภาวะ hyperacidity โดยตรง หรือโดยอ้อม แต่โชคร้ายที่โรคเหล่านี้ ไม่ค่อยได้รับการรักษาด้วยการกำจัดกรด และการล้างพิษแบบเข้มข้น:
• ปวดหัวเรื้อรัง และไมเกรน
• โรคภูมิคุ้มกันบกพร่อง
• โรคปริทันต์อักเสบ และโรคฟันผุ
• ความเมื่อยล้าอย่างต่อเนื่อง
• อาการเสียดท้อง และปัญหาการย่อยอาหาร
• ปวดหลังและกล้ามเนื้อคอตึง
• โรคกลาก และภูมิต้านทานเนื้อเยื่อของผิวหนัง เช่น neurodermatitis
• โรคหอบหืด และโรคภูมิแพ้
• โรคไขข้อ และโรคเกาต์
• เส้นเลือดอุดตัน
• น้ำหนักเกิน
• เซลลูไลท์, ขาหนา
• อาการซึมเศร้า
โรคเหล่านี้ เป็นข้อบ่งชี้ของการที่เซลล์และอวัยวะได้รับสารอาหารอย่างไม่เพียงพอ และมีการสะสมของเสีย ที่เกิดจากการทำให้กรดส่วนเกินเป็นกลาง และเกิดจากกลไก และกระบวนการในร่างกายไม่สามารถทำงานได้ "อย่างเหมาะสม" อีกต่อไป เนื่องจากถูกขัดขวางโดยการสะสมของกรดที่มีความเข้มข้นมากเกินไป ในกรณีที่ไม่มีการรักษาสาเหตุของโรค ทำให้โรคแพร่กระจายอย่างรวดเร็ว และรุนแรงมากขึ้น จนกลายเป็นโรคที่อันตรายถึงชีวิตได้ เช่น มะเร็ง, เบาหวาน เป็นต้น
แพทย์โฮมีโอพาธีย์ระบุว่า ประสิทธิภาพที่ลดลงของการรักษาแบบ homeopathic เกิดจากภาวะ hyperacidity และทำให้เกิดผลการกระตุ้นที่มากขึ้น หรือลดลง ของการนำส่งข้อมูลที่จำเป็นในร่างกาย: ในระดับ pH ต่ำ ร่างกายจะขาดอิเล็กตรอนที่สามารถส่งข้อมูลได้ - ข้อมูลของยาโฮมีโอพาธีย์ จึงยังคงติดอยู่ใน "หนองน้ำ" ของกรดที่กินอิเล็กตรอน
สาเหตุของ hyperacidity
ความสามารถในการขับกรดของเสียของมนุษย์ ได้รับการปรับให้เข้ากับสภาพแวดล้อมก่อนอารยธรรม, ปลอดอิเล็กโตรโมก และปลอดการปล่อยมลพิษ และอาหารมีปริมาณแร่ธาตุและวิตามินสูง มีการออกกำลังกายเป็นประจำ ปริมาณกรดของเสียที่เพิ่มขึ้น ต้องการความพยายามเพิ่มเติมจากอวัยวะ สำหรับการขับกรดของเสียที่เกิดขึ้น อย่างไรก็ตาม หากไม่ได้รับการจัดการอย่างเหมาะสม กรดของเสียที่ท่วมท้นของวิถีชีวิต "แบบอารยะ" จะเกินความสามารถของร่างกายในการขับออก
สาเหตุหลักคือ:
พฤติกรรมการกินไม่ตรงตามความต้องการของร่างกาย เรามักจะกินมากเกินไป เร็วเกินไป ผิดลำดับ และผิดเวลาของวัน
อาหารเปลี่ยนไป ปัจจุบันเนื้อสัตว์และผลิตภัณฑ์จากนมเป็นส่วนประกอบหลักของอาหารของเรา เนื้อสัตว์ก่อตัวเป็นกรดซัลฟิวริกในระหว่างการย่อยอาหาร, โปรตีนจากนมจากแหล่งอื่นที่ไม่ใช่จากนมแม่นั้น ยากที่จะดูดซึมเข้าสู่ร่างกายมนุษย์
คุณภาพของอาหารแย่ลง สารกันบูด และสารเคมี, ปุ๋ย และยาฆ่าแมลง มีความเป็นกรดสูง ปริมาณแร่ธาตุ และวิตามินในอาหารลดลงอย่างมาก ในช่วงหลายทศวรรษที่ผ่านมา
ลำไส้ได้รับความเสียหาย ในคนจำนวนมาก แบคทีเรียที่ดีในลำไส้ได้รับความเสียหายอย่างมาก และถูกแทนที่ด้วยเชื้อราที่ชอบกรด
สารกระตุ้น เช่น ยาสูบ, แอลกอฮอล์, ขนมหวาน, กาแฟ เป็นต้น ก็เป็นแหล่งของกรด
รังสีไม่ก่อประจุ (non-ionizing radiation) ที่เกิดจากอิเล็กโทรสโมก (electrosmog)จากโทรศัพท์มือถือ, โทรทัศน์ และสถานีวิทยุ และการใช้เตาไมโครเวฟ รวมทั้ง รังสีชนิดก่อไอออน (Ionizing radiation) ที่เกิดจากกัมมันตภาพรังสี ขัดขวางการทำงานของเซลล์ ส่งผลให้โมเลกุลของน้ำตาล และไขมัน เกิดปฏิกิริยาออกซิเดชั่นที่ไม่สมบูรณ์ ส่งผลให้มีกรดสูงขึ้น
มลพิษของโลหะหนัก เช่น จากการอุดฟันด้วยอะมัลกัม และแหล่งอื่น ๆ จะก่อให้เกิดสารพิษที่เป็นกรดในร่างกาย และสร้างสภาพแวดล้อมสำหรับแบคทีเรียที่สร้างกรด
วัคซีน เป็นภาระของทารก และเด็กเล็ก สารแปลกปลอมที่เข้าไปในร่างกาย จะไปทำให้อวัยวะที่ทำหน้าที่กำจัดของเสียออก ทำงานมากเกินไป จนไม่สามารถขับกรดของเสียออกได้อย่างถูกต้องอีกต่อไป
ระดับออกซิเจนในร่างกายลดลง จากการหายใจผิดปกติ และการอยู่ในห้องปิด รวมทั้งอากาศที่เลวร้ายในเมือง สารมลพิษที่สูดดมเข้าไป จะก่อให้เกิดกรดในร่างกาย ซึ่งยากต่อการขับออก การทำงานของปอดลดลง เนื่องจากมลพิษทางอากาศ และการสูบบุหรี่ ขัดขวางการหายใจเอา C02 ออก
ความเครียด, ทัศนคติเชิงลบต่อชีวิต และสิ่งรบกวนจิตใจ เป็นสิ่งสำคัญ และส่วนใหญ่ถูกประเมินค่าต่ำเกินไป คนที่มีทัศนคติเชิงบวก มีความอดทนสูง มีเพื่อนมากมาย และชีวิตที่สมหวัง และมีความสุข สามารถรอดพ้นจากโรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง และผลของร่างกายเป็นกรดได้นานขึ้น แม้จะมี "การรับประทานอาหารที่ไม่เหมาะสม" และวิถีชีวิตที่ไม่ดีต่อสุขภาพ ในขณะที่คนที่คลั่งไคล้สุขภาพ ที่มีความหวาดกลัวและสงสัย และทำหลายสิ่งหลายอย่างเพื่อสุขภาพ และใช้ชีวิตเพื่อการมีสุขภาพที่ดีที่สมบูรณ์แบบ กลับผลิตกรดจำนวนมากในร่างกาย จนความพยายามในการทำสิ่งต่างๆของพวกเขาไร้ค่า
ขาดการออกกำลังกาย และการนอนหลับไม่เพียงพอ ทำให้ร่างกายเป็นกรดเกิน
ปัจจุบันนี้ ภาวะสมดุลกรด-ด่าง แทบจะพบได้เฉพาะในทารกที่กินนมแม่ จากแม่ที่มีสุขภาพแข็งแรง และไม่สูบบุหรี่เท่านั้น
ผลทางสังคมของโรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง
คำว่า "โรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง" ครอบคลุมถึง โรคที่การแพทย์เชิงเภสัชศาสตร์ไม่สามารถอธิบายได้ และแน่นอนว่าไม่สามารถรักษาได้ ตั้งแต่ยาต้านโรคหอบหืด ไปจนถึงยารักษามะเร็ง และยานอนหลับ ส่วนแบ่งค่ายาที่มากที่สุด เกิดจากยาต้านโรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง ในปี 2018 ค่าใช้จ่ายรวมสำหรับการดูแลสุขภาพในสหรัฐอเมริกาสูงถึงเกือบ 11,000 เหรียญสหรัฐต่อหัว (เพิ่มมากขึ้น 3,000 เหรียญสหรัฐ เมื่อเทียบกับปี 2010) ในสหราชอาณาจักรประมาณ 3,200 ปอนด์ (เพิ่มมากขึ้น 1,000 ปอนด์ เมื่อเทียบกับปี 2010) ในออสเตรเลียมากกว่า 7,100 เหรียญออสเตรเลีย (เพิ่มมากขึ้น 1,600 เหรียญออสเตรเลีย เมื่อเทียบกับปี 2010) ในเยอรมนี 4,500 € (เพิ่มมากขึ้น 1,000 € เมื่อเทียบกับปี 2010) และในอินเดียประมาณ 5,000 ₹ (เพิ่มมากขึ้น 3,000 ₹ เมื่อเทียบกับปี 2010) ค่าใช้จ่ายด้านสุขภาพนั้นเพิ่มขึ้นอย่างรวดเร็ว และในสหรัฐอเมริกา มีมูลค่าถึง 17% ของ GDP! (สหราชอาณาจักร: 10% ออสเตรเลีย 9.3% เยอรมนี 11% และอินเดีย 3.2%) (ที่มา: สถิติ OECD)
โรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง กำลังเพิ่มขึ้นอย่างต่อเนื่อง และดูเหมือนจะไม่สามารถหยุดยั้งได้ และสื่อไม่ให้ความสนใจ: โรคมะเร็ง, หัวใจวาย และโรคหลอดเลือดสมอง ดูเหมือนจะทำร้ายคนที่มีสุขภาพดีแบบไม่คาดคิด และมักส่งผลร้ายแรง อัตราการเกิดมะเร็งในประเทศ "ตะวันตก" กำลังเข้าใกล้ 50% อย่างช้าๆ ซึ่งหมายความว่า 1 ใน 2 คน จะเกิดเนื้องอกอย่างน้อยหนึ่งครั้งในช่วงชีวิตของพวกเขา จากนั้นก็จะพบกับ "เครื่องจักรมะเร็ง" คือ การผ่าตัด, การฉายรังสี และเคมีบำบัด ซึ่งความสำเร็จในการรักษายังเป็นที่น่าสงสัย และทำให้คุณภาพชีวิตของผู้ป่วยแย่ลง
โรคเบาหวาน, โรคความดันโลหิตสูง, โรคกระดูกพรุน, โรคหอบหืด, โรคไขข้อ, โรคเกาต์, ภาวะหลอดเลือด และโรคอื่น ๆ เป็นโรคที่ค่อยๆเกิดขึ้น แต่มีผลกระทบอย่างชัดเจนต่อคุณภาพชีวิต, แรงจูงใจ และประสิทธิภาพในการใช้ชีวิต โรคเหล่านี้ ทำให้ผู้ที่ได้รับผลกระทบกลายเป็นลูกค้าประจำของอุตสาหกรรมทางการแพทย์ แพทย์ ซึ่งขาดความรู้เกี่ยวกับสาเหตุของโรค จึงพยายามบรรเทาอาการด้วยยา และการรักษาตามอาการ แต่ไม่ได้รับการรักษาที่แท้จริง CDC ซึ่งเป็นศูนย์ควบคุมและป้องกันโรคแห่งสหรัฐอเมริกา พาดหัวข่าวในหน้าเว็บว่า: "90% ของค่าใช้จ่ายด้านการดูแลสุขภาพประจำปีมูลค่า 3.3 ล้านล้านดอลลาร์ของประเทศ เป็นค่าใช้จ่ายสำหรับผู้ที่มีปัญหาสุขภาพเรื้อรัง และปัญหาสุขภาพจิต คำว่า "ปัญหาสุขภาพเรื้อรัง และปัญหาสุขภาพจิต" เป็นเพียงคำเรียกอีกอย่างหนึ่งสำหรับโรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง
ในขณะที่โรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้องบางอย่าง ส่วนใหญ่เกิดจากพฤติกรรม เช่นโภชนาการที่ไม่ดี, การบริโภคเครื่องดื่มที่มีน้ำตาล และกรด เช่น โคล่า และน้ำอัดลม การขาดการออกกำลังกาย เป็นต้น โรคอื่น ๆ โดยเฉพาะโรคมะเร็ง กลับพบอยู่ท่ามกลางพวกเรา โดยไม่คำนึงถึงอายุ, การศึกษา และเพศ ในปี 2559 มีผู้เสียชีวิตด้วยโรคมะเร็งเกือบ 300 รายจาก 100,000 รายในเยอรมนี 260 รายจาก 100,000 รายในสหราชอาณาจักร 190 ราย จาก 100,000 ราย ในออสเตรเลีย และสหรัฐอเมริกา (ที่มา: สถิติ OECD) อย่างไรก็ตาม หากคุณมองอย่างใกล้ชิด คุณจะพบว่า สาเหตุของ "เหยื่อ" ที่เป็นมะเร็งทุกราย เกิดจาก: การแผ่รังสีไมโครเวฟจากโทรศัพท์มือถือ เป็นสาเหตุที่พบบ่อยที่สุด รวมถึงความเครียดในที่ทำงาน หรือในครอบครัวด้วย และมลพิษทางอากาศจากสารเคมี หรือฝุ่น, มลพิษทางน้ำดื่ม เป็นต้น
การทราบว่าอัตราการเกิดโรคพัฒนาไปอย่างไร เมื่อเปรียบเทียบอายุขัยโดยรวม กับอายุขัยของการมีสุขภาพที่ดี เป็นเครื่องมือที่ดี ความแตกต่างระหว่างอายุขัยทั้งสองนี้ คือช่วงชีวิตที่ป่วย ซึ่งต้องขึ้นอยู่กับยา และไม่สามารถอยู่ได้โดยปราศจากความช่วยเหลือ สิ่งนี้สามารถใช้เป็นตัวบ่งชี้สุขภาพของวิถีชีวิต และคุณภาพของระบบสุขภาพในประเทศนั้น ๆ
ตัวอย่างเช่น เราจะเห็นว่าชาวสิงคโปร์โดยเฉลี่ยมีชีวิตที่มีสุขภาพที่ดียาวนานกว่าคนอเมริกันทั่วไปเกือบแปดปี และคนอเมริกันป่วยนานกว่าคนสิงคโปร์มากกว่า 3 ปี ในขณะที่ในสิงคโปร์ จะเห็นว่า เวลาของชีวิตที่ต้องเจ็บป่วยลดลงเรื่อยๆด้วยซ้ำ ตรงกันข้ามกับพัฒนาการในประเทศอื่น ๆ ที่ช่วงชีวิตที่ต้องเจ็บป่วยเพิ่มขึ้นอย่างต่อเนื่อง
โรคที่เกิดจากการดำรงชีวิตที่ไม่ถูกต้อง ที่มีผู้เสียชีวิตสูงสุด
น่าเสียดายที่โรคจากวิถีชีวิต ไม่เพียงทำให้คุณภาพชีวิตแย่ลง แต่ยังเป็นสาเหตุของการเสียชีวิตก่อนวัยอันควรมากขึ้นเรื่อย ๆ ซึ่งมักเกิดจากความเจ็บปวดอันยาวนาน, การเข้ารับการรักษาในโรงพยาบาล และการใช้ยาที่มีผลข้างเคียงมากมาย
โรคทางเดินหายใจ โดยเฉพาะปอดอุดกั้นเรื้อรัง (COPD)และโรคหอบหืด เป็นสาเหตุการเสียชีวิตอันดับ 3 ในสหรัฐอเมริกา จากข้อมูลของ CDC ชาวอเมริกัน 1 ใน 13 คนเป็นโรคหอบหืด คิดเป็น 7.7% ของผู้ใหญ่, 8.4% ของเด็ก รวมมากกว่า 25 ล้านคน ในปี 2560 มีผู้เสียชีวิตด้วยโรคทางเดินหายใจจำนวน 154,596 คน
โรคหอบหืด เกิดจากปฏิกิริยาการแพ้ของร่างกายต่อสารจากสิ่งแวดล้อม เป็นการตอบสนองที่ไม่ถูกต้องของระบบภูมิคุ้มกัน ซึ่งเกิดจากการทำงานผิดปกติของเอนไซม์ เอนไซม์มีประสิทธิภาพและการทำงานบกพร่องอย่างมาก เนื่องจากร่างกายเป็นกรดมากเกินไป และการขาดแร่ธาตุ ภาวะการหายใจเร็วเกินไปที่เกิดจากความเครียด ซึ่งเกิดขึ้นในวัยเด็ก ส่งผลต่อพัฒนาการของโรคหอบหืด เนื่องจากปอดไม่สามารถระบายอากาศ และทำความสะอาดได้อย่างเหมาะสมอีกต่อไป โรคหอบหืด และโรคทางเดินหายใจอื่น ๆ ส่วนใหญ่ เช่น หลอดลมอักเสบ, โรคหลอดเลือดหัวใจตีบ ฯลฯ สามารถป้องกันได้ หากมีการปลูกฝังวิถีชีวิตที่มีความเครียดน้อยลง และมีการเรียนรู้ และฝึกฝนการหายใจในช่องท้องอย่างช้าๆเพื่อสุขภาพ
โรคมะเร็ง ซึ่งเป็นสาเหตุการเสียชีวิตอันดับ 2 สามารถให้การรักษานานขึ้น และนานขึ้นเรื่อยๆ ด้วยเทคโนโลยี และยาที่มีค่าใช้จ่ายในการรักษาหลายพันเหรียญสหรัฐต่อเดือน ในปี 2561 มีผู้ป่วยมะเร็งรายใหม่ 1,735,350 รายเกิดขึ้นในสหรัฐอเมริกาเพียงแห่งเดียว มีผู้เสียชีวิตประมาณ 600,000 คน ซึ่งเป็น 186 คนต่อประชากร 100,000 คน และคิดเป็น 21.7% ของการเสียชีวิตทั้งหมดในสหรัฐอเมริกา เกือบทุกๆวินาที มีพลเมืองสหรัฐที่จะประสบกับชะตากรรมนี้ตลอดชีวิตของเขา ในปี 2561 มีผู้ป่วยมะเร็งประมาณ 18 ล้านคนทั่วโลก ค่าใช้จ่ายในการรักษาแตกต่างกัน เนื่องจากในประเทศยากจน การรักษามะเร็งสมัยใหม่นั้นไม่สามารถจ่ายได้สำหรับผู้ป่วยส่วนใหญ่ ทั่วโลกมีผู้เสียชีวิตจากโรคมะเร็งเกือบ 10 ล้านคน
มีการใช้จ่ายเงินประมาณ 2 แสนล้านเหรียญสหรัฐสำหรับการรักษาโรคมะเร็งในสหรัฐอเมริกาในปี 2558 ซึ่งประสบความสำเร็จในระดับปานกลาง เนื่องจากผู้ป่วยมะเร็งกว่าครึ่งยังคงเสียชีวิตภายใน 5 ปีหลังจากการปรากฏตัวของเนื้องอกครั้งแรก
จากการศึกษาของสำนักงานสิ่งแวดล้อมอเมริกันพบว่า ประมาณ 35% ของผู้ป่วยมะเร็ง เกิดจากโภชนาการที่ไม่ดี และ 30% จากการสูบบุหรี่ อย่างไรก็ตาม เนื่องจากปัจจัยต่างๆ เช่นการแผ่รังสีคลื่นขนาดเล็ก และความเครียด เป็นเรื่องยากมากที่จะตรวจจับ และสอบถาม จึงสามารถสันนิษฐานได้ว่า ปัจจัยเหล่านี้มีส่วนอย่างมากที่ทำให้อุบัติการณ์ของมะเร็งเพิ่มขึ้น โดยเฉพาะอย่างยิ่งเมื่อปัจจัยเหล่านี้เพิ่มปัจจัยเครียดอื่น ๆ การแพทย์ที่มุ่งเน้นยา ยังไม่สามารถนำเสนอสาเหตุของมะเร็งได้อย่างน่าเชื่อถือ ซึ่งเป็นสาเหตุที่แนวทางการรักษาแบบเดิมทั้งหมดล้มเหลวในตอนท้าย ในช่วงต้นปี 1924 ผู้ได้รับรางวัลโนเบล แพทย์ และนักชีวเคมี Otto Heinrich Warburgกล่าวว่า "สาเหตุของมะเร็ง คือการทดแทนการหายใจด้วยออกซิเจนของเซลล์โดยการหมัก (fermentation)" ผลการวิจัยล่าสุดยืนยันการวิจัยของเขา การหมักเกิดขึ้นเมื่อเซลล์ไม่ได้รับออกซิเจนเพียงพออีกต่อไป สาเหตุหลักของการขาดออกซิเจนคือความเป็นกรดมากเกินของเนื้อเยื่อเกี่ยวพัน ซึ่งขัดขวางไม่ให้ออกซิเจนในเส้นเลือดฝอยเข้าถึงเซลล์ เนื้อเยื่อเกี่ยวพันที่เป็นกรดมากเกินไป ยังป้องกันไม่ให้สารตกค้างจากการเผาผลาญที่เป็นกรดที่เกิดขึ้นในเซลล์ร่างกาย ถูกเคลื่อนย้ายออกไป ทำให้พวกมันยังคงอยู่ในเซลล์ กลายเป็นกรดที่เพิ่มขึ้นอย่างต่อเนื่อง และในที่สุดก็เปลี่ยนจากการหายใจด้วยออกซิเจนเป็นการหมัก ความเครียดออกซิเดทีฟ (Oxidative stress)ซึ่งทำร้ายเซลล์ จะสนับสนุนการก่อตัวของเซลล์มะเร็ง
เรียกได้ว่าเป็นเรื่องอื้อฉาว ที่แม้จะมีอัตราการรักษาต่ำกว่า 50% แต่ผู้ป่วยมะเร็งเกือบทุกรายในประเทศร่ำรวยของโลก ต้องได้รับความเจ็บปวดจากการผ่าตัด, การฉายรังสี และเคมีบำบัดในขณะที่แนวทางอื่นที่ใช้ผลการวิจัยทางวิทยาศาสตร์ของ Otto Heinrich Warburg และแพทย์และนักวิทยาศาสตร์ที่สำคัญอื่น ๆ เช่น Dr Aifons Weber , Dr Johanna Budwig ไม่สามารถเข้าถึงอย่างเป็นทางการได้ ดูเหมือนว่าการรักษาโรคมะเร็งจะเฟื่องฟูเกินกว่าที่อุตสาหกรรมจะอนุญาตให้ใช้วิธีการ และมาตรการการรักษาที่มีประสิทธิภาพมากขึ้น และถูกกว่ามาก
สาเหตุของการเสียชีวิตที่พบบ่อยที่สุดคือ โรคหัวใจและหลอดเลือด ซึ่งเป็นคำที่ครอบคลุมรวมหลายภาวะ รวมถึง โรคหลอดเลือด, โรคหัวใจ, หัวใจล้มเหลว, โรคหลอดเลือดสมอง, หัวใจวาย, หัวใจเต้นผิดจังหวะ และปัญหาลิ้นหัวใจ ซึ่งทั้งหมดนี้เป็นผลโดยตรงหรือโดยอ้อมของความดันเลือดที่สูง ในสหรัฐอเมริกา โรคหัวใจและหลอดเลือดทำให้เกิดการเสียชีวิตประมาณ 1 ใน 3 ของผู้เสียชีวิต ทั้งหมด 850,000 คนในปี 2559
จากข้อมูลของ American Heart Association พบว่า เกือบครึ่งหนึ่งของผู้ใหญ่ทั้งหมดในสหรัฐอเมริกา ต้องทนทุกข์ทรมานจากโรคหัวใจ และหลอดเลือด และความดันโลหิตสูง พวกเขาใช้ยาที่เต็มไปด้วยผลข้างเคียง เพื่อลดความดันโลหิต โดยลืมไปว่า การควบคุมของร่างกายจะเพิ่มความดันโลหิตโดยมีจุดประสงค์เพื่อเพิ่มปริมาณออกซิเจนไปยังเซลล์ของร่างกาย เช่นเดียวกับโรคหอบหืด และมะเร็ง การที่เซลล์ของร่างกายมีออกซิเจนไม่เพียงพอเป็นสาเหตุหลักของโรคหัวใจและหลอดเลือด ปัญหาการไหลเวียนของเลือดจะทวีความรุนแรงขึ้นอีกด้วยปัจจัยสองประการ: หลอดเลือดแดงแคบลง โดยการสะสมของโปรตีนที่แข็งตัว และไขมันที่ถูกออกซิไดซ์ ซึ่งถูกทำให้เป็นกลางโดยแร่ธาตุอัลคาไลน์ของร่างกาย สิ่งนี้ถูกเรียกอย่างผิดๆว่า การกลายเป็นหินปูน (calcification) การที่หลอดเลือดหดตัวนี้ สามารถนำไปสู่การอุดตัน ซึ่งทำให้เซลล์ และอวัยวะของร่างกายขาดเลือดไปหล่อเลี้ยง สิ่งที่อุดตันหลอดเลือดนี้ สามารถหลุดออก และไปปิดกั้นหลอดเลือดแดงอย่างกะทันหัน และทำให้เกิดโรคหลอดเลือดสมอง การออกซิเดชั่น และการแผ่รังสีไมโครเวฟ ทำให้เซลล์เม็ดเลือดแดงรวมตัวกันจนเรียกว่า "ม้วนเงิน (money rolls)" ส่งผลให้เลือดหนืด และขัดขวางการขนส่งออกซิเจน
ดังนั้น การเกิดภาวะ hyperacidity, การหายใจผิดปกติ และการฉายรังสีไมโครเวฟ มักเป็นสาเหตุของการเสียชีวิตอย่างกะทันหัน และไม่คาดคิด หรือความพิการตลอดชีวิต










